上海有机所交叉中心与合作者共同揭示CDK12/13双重抑制在卵巢癌治疗的两面性
发布时间:2022-07-27交叉中心| 【 大 中 小 】【打印】 【关闭】
卵巢癌是妇科肿瘤中致死率很高的癌种,目前铂类化疗药物与PARP抑制剂是卵巢癌临床治疗的主要药物。另一方面,细胞周期蛋白激酶CDK12及其同源的CDK13,因对超级增强子驱动的癌基因、DNA损伤修复基因的表达起重要调控作用,被认为是卵巢癌以及其他恶性肿瘤临床治疗的潜在靶标。基于丙烯酰胺类共价弹头的THZ531,通过共价靶向CDK12/13激酶域保守的半胱氨酸残基实现对其高活性、高特异性的抑制,然而却受限于药代性质难以进一步应用于动物模型研究;而SR-4835等其他非共价抑制剂,则是通过分子胶水机制降解Cyclin-K,进而间接抑制CDK12/13的激活。
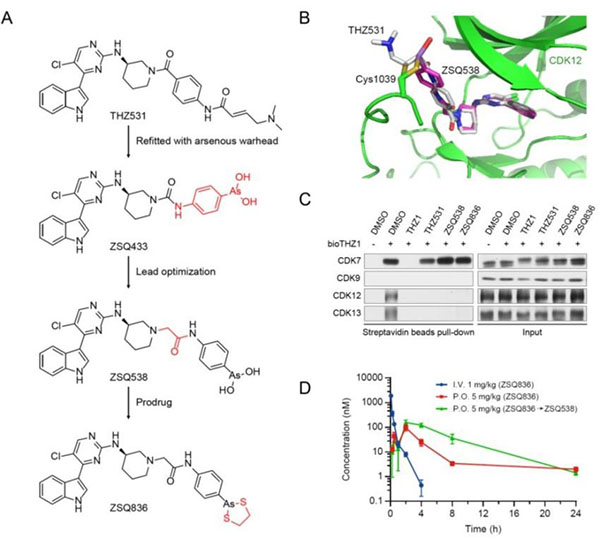
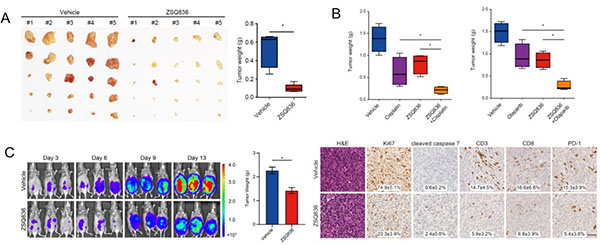
中国科学院上海有机化学研究所生物与化学交叉研究中心谭立课题组与仁济医院、上海市妇科肿瘤重点实验室的庄光磊、狄文课题组合作,近日在Cancer Research期刊上发表研究论文“Dual inhibition of CDK12/CDK13 targets both tumor and immune cells in ovarian cancer”,报道了基于亚砷酸弹头的高活性、高特异性、且具备口服生物利用度的有机胂CDK12/13抑制剂ZSQ836的研制,以及对CDK12/13作为卵巢癌治疗靶点可行性的进一步评估。该项研究发现,利用亚砷酸共价弹头替代常用的靶向半胱氨酸的丙烯酰胺类共价弹头、基于结构导向设计研制的ZSQ836不但在活性与特异性上均与THZ531相当,且在药代动力学性质上远优于后者(图1)。在免疫缺陷的小鼠模型上,ZSQ836很好地抑制了卵巢癌肿瘤的生长,并与铂类化疗药物或PARP抑制剂产生显著的协同疗效。然而,在免疫正常的小鼠模型上,CDK12/13的双重抑制不但在癌细胞中显著下调了多个促癌基因、并引起DNA损伤,同时还抑制了T细胞的增殖与激活,进而限制了肿瘤中的淋巴浸润(图2)。
图1 有机胂CDK12/13共价抑制剂ZSQ836的研制
这些发现表明,在卵巢癌或其他癌症临床治疗中,同时靶向CDK12/13可能难以实现理想的疗效窗口。而CDK12或CDK13的单激酶抑制剂,或是利用特异性药物递送技术,可能才是更有利的临床干预手段。另一方面,有机胂CDK12/13抑制剂ZSQ836的研制与应用也充分证明,亚砷酸官能团可以作为共价靶头,用于研制新型的靶向型共价调控剂。仁济医院、上海市妇科肿瘤重点实验室的庄光磊、狄文课题组,以及交叉中心李盈副研究员是这项研究的主要合作者。该项研究受国家自然科学基金委、上海市科委和中国科学院资助完成。
图2 ZSQ836在免疫缺失或正常的小鼠卵巢癌模型中的药效