上海有机所在镍催化吡啶不对称C-H官能团化反应方面取得进展
发布时间:2022-07-27金属有机化学国家重点实验室| 【 大 中 小 】【打印】 【关闭】
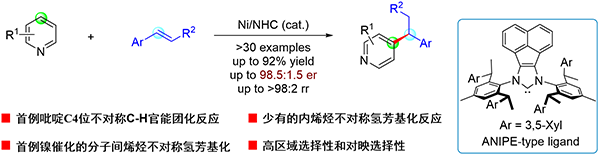
吡啶是一类广泛存在于药物和天然产物分子中的重要分子骨架,同时也是重要的有机合成中间体以及配体结构单元,因此对吡啶环进行直接转化具有重要意义。吡啶的不对称C-H官能团化反应可以以高步骤经济性得到手性吡啶,是合成这类产物的理想方法。但是到目前为止,仅有少数几例的吡啶不对称C-H官能团化反应报道,且反应仅发生在吡啶2位,而吡啶4位的不对称C-H官能团化反应还未有报道。
中国科学院上海有机化学研究所金属有机化学国家重点实验室施世良课题组一直致力于发展新型手性氮杂环卡宾配体及其在挑战性转化中的应用。该组相继报道了ANIPE和SIPE系列新型大位阻手性氮杂环卡宾配体,并应用于镍催化的吡啶(J. Am. Chem. Soc. 2019, 141, 5628.)和多氟芳烃衍生物(Angew. Chem., Int. Ed. 2019, 58, 13433.)的分子内不对称C-H烷基化反应。近期,他们利用这类大位阻的手性氮杂环卡宾配体首次实现了吡啶4位的分子间不对称C-H官能团化反应(J. Am. Chem. Soc. 2022, DOI:10.1021/jacs.2c04043. 见图1)。以反式β取代苯乙烯和吡啶作为原料,可以发生高效的、100%原子利用率的氢芳基化反应,以优秀的区域选择性(大于98/2 rr)和对映选择性(高达97% ee)得到一系列手性烷基吡啶。该方法具有良好的底物适用性,苯乙烯底物苯环上可以兼容各类烷基、烷氧基以及吗啉、哌啶、吡咯等杂环,反应均能以优秀的区域选择性得到马氏选择性的产物。2位具有取代基的吡啶以及喹啉均可以顺利发生反应。通过开展控制实验,发现反式烯烃和顺式烯烃在反应活性和区域选择性上存在着较大差异,反式烯烃作为底物时具有更高的反应活性、区域选择性以及对映选择性。与山东大学张冬菊教授课题组合作进行理论计算后,作者认为这种差别产生的原因是反式烯烃中的芳环与卡宾配体手性片段中的苯基之间有强的π-π相互作用,致使反应活化能更低,且生成R和S构型产物的过渡态能量差更大。同时理论计算表明,该反应通过配体-配体氢转移机理发生,且该步是反应的决速步和对映选择性控制步骤。该研究工作为吡啶4位的不对称C-H官能团化反应提供了一种高效的方法,同时也实现了首例镍催化的烯烃分子间不对称氢芳基化反应。
图1 镍催化的吡啶对位不对称C-H烷基化反应
以上工作得到国家重点研发计划、国家自然科学基金委、中科院、上海有机所以及金属有机化学国家重点实验室的大力资助。