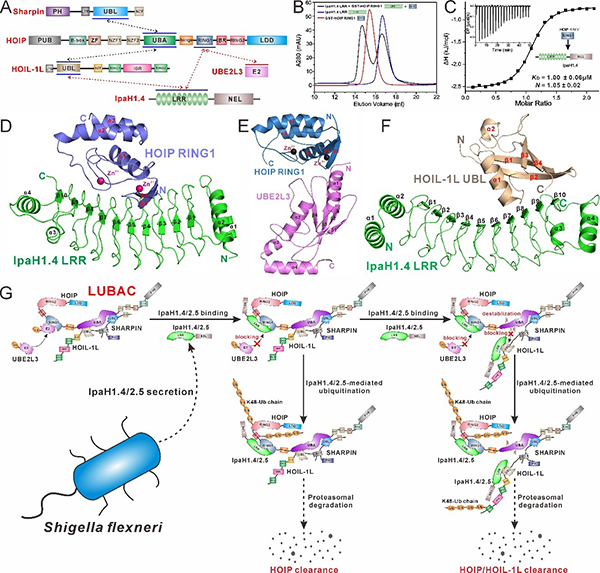
泛素化修饰(ubiquitination)是一种可逆的蛋白质翻译后修饰,可以被多种信号因子调节,几乎参与所有重要的生命过程。线性泛素链组装复合物(LUBAC)由催化亚基HOIP和两个调节亚基HOIL-1L和SHARPIN所组成,是目前已知唯一一个可以催化线性泛素链形成的E3泛素连接酶复合物。LUBAC可以被招募到多种信号通路中,并参与调控上下游信号通路的转导。其中,LUBAC催化产生的线性泛素链可以作为支架蛋白招募下游的效应蛋白,广泛地参与NF-κB等多条信号通路,在先天免疫、细胞死亡以及抗入侵病原体的选择性自噬等过程中发挥重要作用。福氏志贺氏菌是一种革兰氏阴性菌,是细菌性志贺氏菌病的主要元凶,每年导致很多病例死亡。为了在感染期间逃避宿主的免疫反应,福氏志贺氏菌会分泌两种高度相似的E3泛素连接酶,IpaH1.4和IpaH2.5,抑制宿主细胞中的LUBAC。然而,IpaH1.4/2.5破坏LUBAC的具体分子机制尚不清楚。
近期,中科院上海有机化学研究所生命有机化学国家重点实验室的潘李锋研究组在美国科学院院刊(
PNAS)在线发表了题为“Mechanistic insights into the subversion of the linear ubiquitin chain assembly complex by the E3 ligase IpaH1.4 of
Shigella flexneri”的研究论文(
https://www.pnas.org/doi/full/10.1073/pnas.2116776119)。在该项研究中,其团队成员综合运用核磁共振技术、等温滴定量热技术、快速蛋白液相色谱等生化研究手段发现IpaH1.4分别通过其LRR结构域特异性识别HOIP的RING1结构域和HOIL-1L的UBL结构域,并首次解析了IpaH1.4 LRR/HOIP RING1复合物、IpaH1.4 LRR/HOIL-1L UBL复合物以及HOIP RING1/UBE2L3复合物的高分辨晶体结构,详细阐明了IpaH1.4识别HOIP和HOIL-1L的分子机理,同时揭示了IpaH1.4对HOIP的识别可以抑制HOIP与E2的结合。此外,还证明了IpaH1.4 LRR与HOIP RING1或HOIL-1L UBL的相互作用是HOIP或HOIL-1L在体外泛素化以及IpaH1.4抑制细胞内NF-κB激活所必需的。总之,他们的研究工作表明IpaH1.4会同时采用三种不同的策略来破坏LUBAC的功能,进而抑制宿主细胞NF-κB信号通路的激活和降解入侵病原体的选择性自噬过程:1)通过介导HOIP的K48型泛素化修饰,促进HOIP的蛋白酶体降解过程;2)通过竞争结合HOIP的RING1上的E2结合位点来抑制LUBAC的E3酶活性;3)通过作用于HOIL-1L的UBL结构域介导HOIL-1L的K48型泛素修饰和蛋白酶体降解,并竞争抑制HOIL-1L结合HOIP的能力,降低LUBAC的稳定性。此项研究工作首次从生化和结构角度完整揭示了福氏志贺氏菌的E3效应蛋白IpaH1.4/2.5采用多种“伎俩”破坏LUBAC的分子机制,并为未来抗福氏志贺氏菌感染的药物研发提供了新的潜在作用靶标。
潘李锋课题组的刘建平副研究员、博士生王亚茹以及上海交通大学姚玉峰课题组的王丹霓博士为本文的共同第一作者。上述研究工作得到国家自然科学基金委、科技部、中科院和生命有机化学国家重点实验室的资助。
图1 福氏志贺氏菌效应蛋白IpaH1.4/2.5破坏宿主细胞LUBAC复合物的作用机理