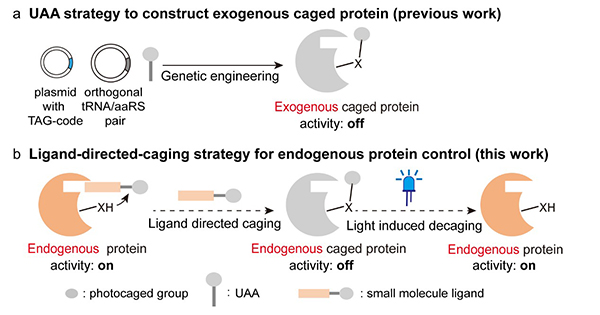
光调控蛋白有助于高时空分辨精度的探索动态生物功能。光遗传学基于光敏蛋白实现光调控在过去十几年极大推动了神经科学及相关生命科学的发展。在众多光遗传学方法中,光加笼蛋白策略独具特色,可以通过光释放蛋白活性残基实现位点特异性的蛋白光调控。目前,光加笼蛋白需要通过遗传编码的非天然氨基酸引入技术构建(图1a)。然而,遗传编码的光敏蛋白引入方式无法实现内源蛋白的调控,因此无法研究原生环境内源蛋白功能,也难以进行后续的疾病治疗应用。为此,小分子策略提供了具有吸引力的解决方案,但是广为使用的小分子光去笼方法所释放的活性小分子会无限制自由扩散,降低了该方法的时空分辨精度。中国科学院上海有机化学研究所陈以昀课题组一直致力于生物相容光化学新方法的发展与应用,首次报道了基于有机小分子染料的光催化反应实现活细胞内的生物活性小分子释放(Angew. Chem., Int. Ed. 2019, 58, 561)及蛋白质选择性标记(JACS Au 2021, 1, 7, 1066),通过小分子染料的亚细胞定位性提供了细胞内的高时空分辨光释放与光标记。近日,陈以昀课题组发展了基于光敏感小分子配体的内源蛋白加笼策略,首次实现了光化学调控活细胞内源DNA修复酶功能(Angew. Chem., Int. Ed. 2022, doi: 10.1002/anie.202115472,图1b)。
图1 非天然氨基酸遗传编码与小分子配体的光调控蛋白策略
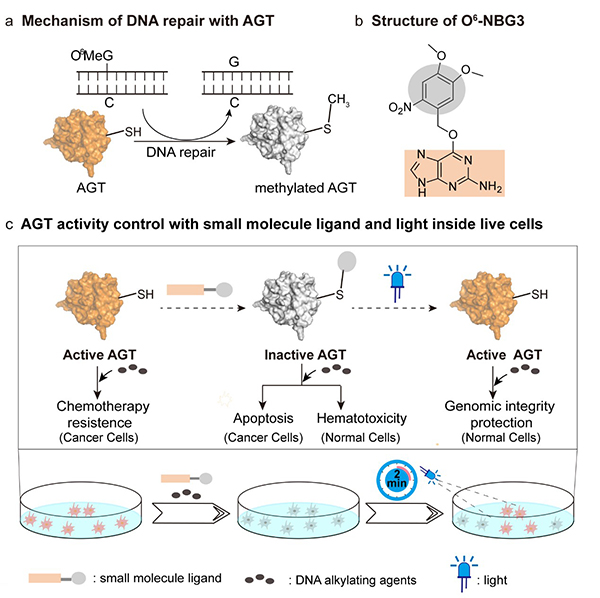
O6-烷基鸟嘌呤-DNA烷基转移酶(O6-alkylguanine-DNA alkyltransferase, AGT)是哺乳动物细胞DNA烷基化损伤修复的关键蛋白,也是癌症病理学及治疗学研究的重要靶点蛋白(图2a)。AGT在癌细胞及正常细胞均普遍存在,通过药物小分子抑制AGT活性可以提高烷化抗癌试剂的治疗效果。然而,药物小分子对癌细胞AGT抑制的同时对正常细胞AGT也会不可避免的抑制,导致无法及时修复DNA损伤,进而表现出血液毒性等副作用(图2c)。根据AGT的化学反应机理,陈以昀课题组设计并合成了多个AGT的光敏感小分子配体(图2b)。通过有效分子浓度提升,AGT的145位半胱氨酸活性残基被小分子配体O6-NBG3的光敏感基团特异性修饰,从而封闭了其DNA修复功能。O6-NBG3加笼的烷基化AGT在紫外光或可见光照射下,可以特异性的释放145位半胱氨酸活性位点并恢复其DNA修复功能。该光调控方法在纯蛋白体系、大肠杆菌及哺乳细胞体系可以实现AGT功能的快速开关控制,且具有光剂量依赖性。O6-NBG3可以实现哺乳动物细胞内源AGT的光调控,首次展示了乳腺癌MCF-7细胞对烷化试剂耐受性的时空选择性光干预(图2c)。经O6-NBG3处理的MCF-7细胞对抗癌药物卡莫司汀(BCNU)表现出高敏感性,降低了细胞存活率;而光照可以提高O6-NBG3处理的MCF-7细胞的BCNU耐药性,从而提升了细胞存活率。
图2 细胞内源AGT的光调控及癌细胞选择性抑制应用
该研究为靶向抑制癌细胞AGT活性的癌症治疗提供了新思路。基于小分子配体的加笼策略可实现内源蛋白活性位点的时空选择性光干预,为内源蛋白研究提供了具有吸引力的小分子配体解决方案。相关研究成果近期以“Ligand-Directed Caging Enables the Control of Endogenous DNA Alkyltransferases Activity with Light inside Live Cells”为题发表在Angew. Chem., Int. Ed.。上海有机所张祎昕副研究员、韩丽丽(上科大联合培养)为文章共同第一作者。上述研究工作得到国家自然科学基金、中国科学院创新交叉团队项目、上海市科委、中国科学院战略性先导科技专项(B类)、生命有机化学国家重点实验室的大力资助。