2021年10月29日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组在Nature Communications上发表一项最新研究成果,标题为 “The hereditary mutation G51D unlocks a distinct fibril strain transmissible to wild-type α-synuclein”。该工作中作者发现α-syn遗传突变G51D可形成一种全新的α-syn病理纤维类型(strain)。这种新的G51D strain具有比WT strain更低的结构稳定性和更强的细胞毒性,并且可以通过交叉接种(cross-seeding)的方式诱导WT α-syn形成类似于G51D strain的聚集。
α-Syn蛋白的病理性淀粉样聚集是帕金森病(Parkinson’s disease, PD)及多种突触核蛋白病的主要病理标志,这种病理性聚集在细胞间的传递和脑区间的扩散是PD病理机制中的重要部分。现已发现α-syn单位点的遗传突变(G51D,A53T,E46K等)是家族性PD(fPD)的重要驱动因素,研究α-syn单位点遗传突变如何影响其病理性聚集对于阐释fPD的病理机制至关重要。
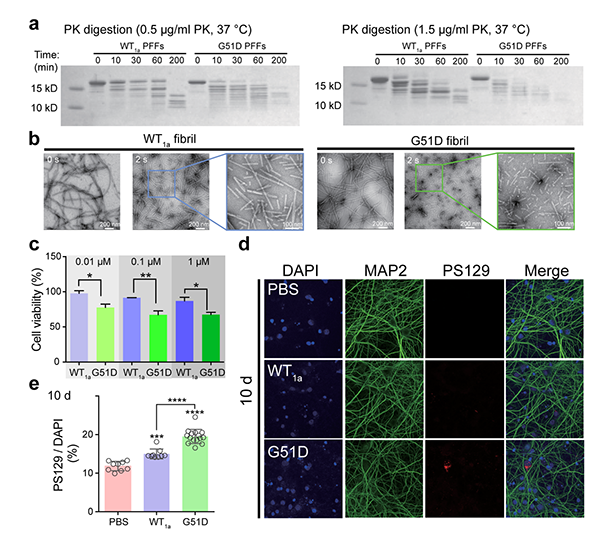
在本工作中,作者首先表征了G51D α-syn strain的理化和病理性质,结果发现G51D strain具有不同于WT strain的右手螺旋构象,并且具有较低的纤维结构稳定性;此外,G51D strain具有更强的细胞毒性且可诱导神经元内源α-syn形成更多聚集(图1)。作者进一步利用冷冻电镜技术解析了G51D strain的高分辨率结构,发现G51D strain形成了与WT strain不同的具有更小的纤维核心的结构。该构象与之前发现的E46K strain具有相似性,不同的是51位点的突变破坏了E46K strain中原有的由残基45-53组成的β-发夹。
图1. 与WT strain相比G51D strain具有更低稳定性、更强细胞毒性且可诱导神经元内源性α-syn形成更多聚集的能力
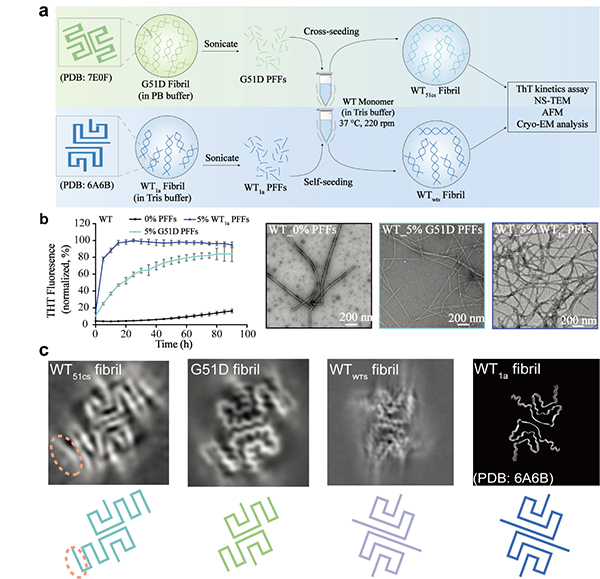
目前已发现携带G51D突变的fPD病人均是杂合突变,WT与G51D α-syn共同存在于体内。那么,G51D strain是否能够影响WT α-syn纤维的组装呢?作者通过cross-seeding的实验发现G51D 的纤维种子可以加速WT α-syn单体的聚集,并且诱导WT单体形成与G51D strain相同的右手螺旋纤维。研究者通过三维电镜重构进一步发现,G51D strain的种子能够诱导WT α-syn形成G51D strain的构象(图2)。因此,更强细胞毒性的G51D strain 可能会扩散到WT α-syn,从而协同加速fPD病人的病程。
图2. G51D strain通过cross-seeding诱导WT α-syn单体聚集形成G51D strain的构象
此外,作者还发现了一个有趣的现象:相比于WT 和G51D单体独立自组装体系,WT 和G51D二者混合能显著增强系统中蛋白淀粉样聚集的能力。并且,WT和G51D α-syn能够共同组装形成具有新结构特征的纤维,其中的共组装分子机理研究还在进行中。综上,本研究工作增加了我们对遗传突变和WT α-syn淀粉样纤维组装机制以及不同病理性strain选择性问题的理解,为了解α-syn 病理性淀粉样纤维组装机制和fPD的致病机理的研究提供了新的视角。
中国科学院上海有机化学研究所生物与化学交叉研究中心为本工作第一单位,刘聪研究员为本文的通讯作者,孙云鹏、龙厚芳同学为论文的共同第一作者。这项工作得到了张耀阳研究员的帮助和支持,研究工作同时得到了国家重点基础研究发展规划项目、国家自然科学基金委、上海市科委、中国科学院和国家蛋白质科学中心的支持。