含有RNA结合蛋白TAR DNA-binding protein (TDP-43) 的异常蛋白聚集是肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis, ALS) 和额颞叶痴呆 (frontotemporal dementia, FTD) 的关键病理标志物。ESCRT复合物蛋白charged multivesicular body protein 2B (CHMP2B) 也是一个与ALS和FTD都相关的致病蛋白,其致病机制被认为主要是它的突变引起内溶酶体-自噬通路功能障碍导致的。有趣的是,尽管超过95%的ALS病人和近45%的FTD病人中有TDP-43蛋白的异常聚集,在CHMP2B最常见的CHMP2BIntron5突变引起的FTD中没有检测到TDP-43蛋白的异常改变。因此,在以前发表的工作中,从未有人把TDP-43和CHMP2B这两个与ALS/FTD都相关的致病蛋白进行过分子机制上的关联研究。
2021年11月2日,中国科学院上海有机化学研究所生物与化学交叉研究中心方燕姗研究员课题组,在Journal of Cell Biology 在线发表题为“CHMP2B regulates TDP-43 phosphorylation and cytotoxicity independent of autophagy via CK1”的论文,该研究发现了CHMP2B可以通过非自噬依赖的途径调控TDP-43的磷酸化和细胞毒性。
在这项工作中,研究人员首先通过果蝇筛选实验发现CHMP2B的敲低可以改善TDP-43引起的神经退化的表型,进而综合利用果蝇模型、哺乳动物细胞系和小鼠原代神经元等实验体系,揭示了CHMP2B可以通过调节蛋白激酶CK1的泛素化和由蛋白酶体介导的CK1蛋白降解过程来改变CK1的蛋白水平,从而最终影响TDP-43蛋白的磷酸化。CK1在CHMP2B调控TDP-43磷酸化中的作用是具有特异性的,因为只有改变CK1可以干预CHMP2B对TDP-43磷酸化水平的调节,而操纵另一个已知的TDP-43蛋白激酶TTBK1/2无法改变CHMP2B对TDP-43磷酸化水平的影响。
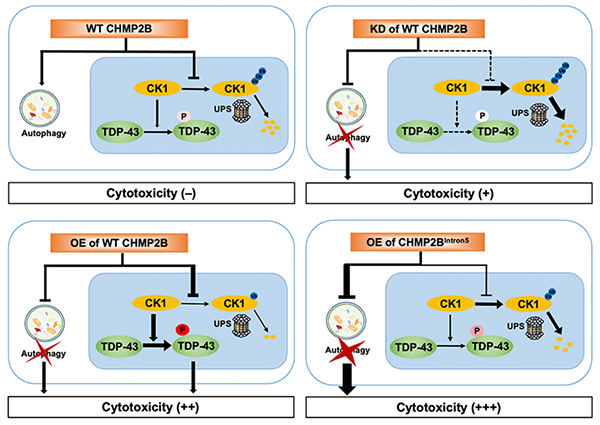
该研究的另一个重要发现是,CHMP2B在自噬通路中的作用和对TDP-43磷酸化的影响可以同时但独立地参与到细胞毒性和神经退化中。特别是,在CHMP2B基因中同一个位点的突变对这两种功能的影响可以是不同的、甚至是相反的。比如CHMP2BIntron5 会引起剧烈的细胞自噬障碍,是一个dominant or hypermorphic mutation;但是对TDP-43磷酸化来讲,CHMP2BIntron5不能像WT CHMP2B那样维持和促进TDP-43的磷酸化,是一个hypomorphic mutation(图1)。这一发现很大程度上帮助了科研人员理解为什么CHMP2BIntron5 引起的FTD病人罕有TDP-43蛋白聚集或高度磷酸化的TDP-43的检出。
此外,该工作还证明了CK1的抑制剂对于TDP-43和CHMP2B引起的神经细胞毒性均有抑制作用,这为发展治疗ALS/FTD以及相关神经退行性疾病的新药提供了方向。
该论文的共同第一作者是中国科学院上海有机所生物与化学交叉研究中心博士生邓雪、孙行和岳文凯,交叉中心方燕姗研究员和暨南大学李昂副教授为共同通讯作者。该研究的经费支持主要来自国家重点研发计划、国家自然科学基金委、中国科学院和上海市科委。
图1. CHMP2B调节自噬和TDP-43磷酸化的双重功能的示意图