中科院天然产物有机合成化学重点实验室何智涛课题组致力于新颖有机合成方法的发展、生物活性分子合成及新药开发等领域。近期,该课题组在
J. Am. Chem. Soc.上在线发表了题为“Stereodivergent Synthesis of Tertiary Fluoride-Tethered Allenes via Copper and Palladium Dual Catalysis”的研究论文(
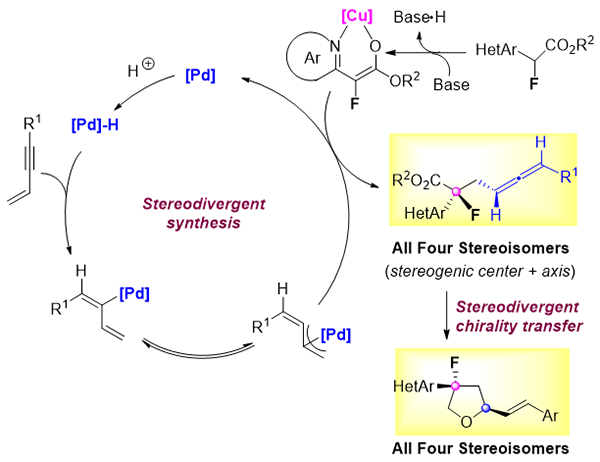
https://pubs.acs.org/doi/10.1021/jacs.1c03157)。该工作突破了传统局限于含多点手性中心的片段的立体发散性合成思路,通过利用Cu/Pd双金属催化共轭烯炔的非对映选择性的氢官能团化策略,实现了一系列兼具点手性和轴手性的片段的立体发散性合成。进一步基于立体发散性合成思路,再次将联烯产物转化得到所有四个氟代氢化呋喃环骨架,验证了该合成方法的可能应用价值。
手性对于药物分子的活性往往具有极大的影响。因此,发展新的合成方法实现同时具有多个手性中心片段的全部立体异构体的获取是一个具有重要科学研究价值的领域和难题。而双催化体系的协同控制策略已被证明是一种简单有效的解决思路。目前,已报道的利用双催化的协同控制策略来进行化合物的立体发散性合成,都是集中于含有点手性中心片段的构建。而对于含有其它手性类型的骨架的立体发散性合成尚未有探索,以及相关的合成应用亦未见报道。另一方面,联烯是一类具有1,2-累积烯烃结构的化合物。由于联烯独特的结构,其在有机合成,药物化学和材料化学等方面的应用都非常广泛。因此发展简单高效的合成轴手性联烯的方法是化学家们一直所追求的目标。此外,全取代的含氟手性中心的构建在新药开发或生物活性分子的制备及评价中占有重要地位,但其构建往往是一类非常具有挑战性的难点。因此,发展高效的不对称催化的方法来构建叔氟手性中心,也是亟待解决的科学问题。
何智涛团队以α-氟代酯和共轭烯炔作为原料,通过手性铜催化剂来选择性地控制亲核试剂α-氟代酯的立体构型,同时利用钯催化共轭烯炔的不对称氢金属化获得亲电性烯丙基钯物种,紧接着发生二者的立体选择性偶联,从而可以合成同时具备中心手性和轴手性的骨架片段。该方法可以在温和的条件下构建出一系列含有三级氟立体中心的手性联烯骨架,对映选择性一般都高达99%以上。通过改变两种手性催化剂的绝对构型,可以方便地制备出产物所有的四个立体异构体,均能获得优异的产率和选择性。此外,利用“轴到点的手性转移”策略,上述反应产物能够方便地转化得到氟代的氢化呋喃环片段,而其也存于很多的生物活性分子的骨架结构中,比如抗HCV病毒药物索非布韦。特别是,从四个手性联烯产物出发,可以构建出所有对应的四个氟代氢化呋喃环骨架,从而实现立体发散性的“轴到点的手性转移”,体现出该方法的应用潜力。
图 合成策略设计及反应转化应用
上述工作主要由博士研究生杨少倩和科研助理王逸凡完成。该研究得到了林国强院士课题组的大力支持。感谢国家自然科学基金委、上海市科委、中科院、上海有机所以及天然产物有机合成化学重点实验室的资助。