

钯催化的交叉偶联方法——2010年诺贝尔化学奖评述
(转载自《中国科学院2011年科学发展报告》)
2010年10月6日,瑞典皇家科学院宣布,本年度诺贝尔化学奖授予美国科学家理查德·赫克(Richard F. Heck)、日本科学家根岸英一(Ei-ichi Negishi)和铃木章(Akira Suzuki)。这三位科学家因发展出“有机合成中的钯催化的交叉偶联方法”而获得此项殊荣。赫克在1972年发现,以钯作为催化剂,能够在较温和的条件下实现碳原子之间的连接[1]。根岸和铃木分别在1977年[2]和1979年[3]进一步发展了利用钯催化交叉偶联碳—碳原子的方法,使该类化学反应的底物和产物类型进一步得到扩展。这些方法能够简单而有效地使稳定的碳原子方便地连结在一起,从而合成结构更为复杂的分子。这些交叉偶联合成方法的诞生,使得化学家操控原子和分子的能力和水平得到空前提升。运用这些方法,很多过去难于合成甚至无法合成的物质已经被轻而易举地创造出来。事实上,他们发明的方法,已经被广泛应用于制药、电子工业和先进材料等领域的科学研究与工业生产。

图1 2010年诺贝尔化学奖获得者
1.Heck反应、Negishi偶联反应和Suzuki偶联反应
有机化学工作者熟知的Heck反应、Negishi偶联反应和Suzuki偶联反应就是以他们的名字命名的,而这些人名反应也正是他们研究成就的精华。其中Heck反应是不饱和卤代烃(或三氟甲磺酸酯)与烯烃在钯催化下生成取代烯烃的偶联反应;Negishi偶联反应是有机锌试剂与卤代烃在镍或钯络合物的催化下发生的偶联反应;Suzuki偶联反应则是在钯络合物催化下,芳基或烯基硼酸或硼酸酯与卤代芳烃或烯烃发生的偶联反应(图2)。
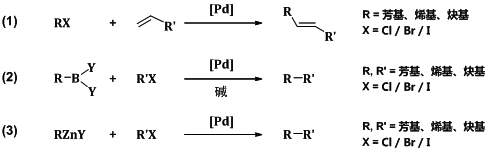
图2 Heck 反应(1)、Suzuki偶联反应(2)和Negishi偶联反应(3)
Heck反应在C-C键构建中具有重要地位,通常用来进行芳香环的官能团化,是经典的傅-克(Friedel-Crafts)反应的一个补充;Negishi偶联反应条件温和、选择性高且底物的耐受性好,被广泛应用于复杂天然产物的全合成;Suzuki偶联是现代有机合成中形成碳-碳键最为普遍的方法之一,是目前制备联芳烃及其衍生物最为方便、可靠的策略。殷元骐先生曾在2003年的本系列丛书的科学前沿栏目专题介绍了“有机钯”的相关内容[4],其中包括了Heck和Suzuki的工作。
2.三类偶联反应的研究新进展
对于上述三类反应,早期主要采用碘代或溴代等不饱和卤代烃作为偶联底物,近年来随着催化剂的进步,特别是有机膦配体的发展,使得在偶联反应中使用价廉易得的惰性不饱和氯代烃成为可能,同时催化的效率也得到大幅度提高[5]。虽然对Heck反应的研究已有将近四十年的历史,但催化的不对称Heck反应则直到1989年才有报道[6],事实上对于通过分子内反应构建环状体系中的手性叔碳和季碳中心,不对称Heck反应已经发展成为一类可靠方法[6b],但是分子间的不对称Heck反应仍然是一个具有挑战性的研究方向。另外,钯催化的不对称交叉偶联反应是近年来此领域另一重要进展,对映选择性的Suzuki偶联反应已经成为合成手性联芳烃类化合物的重要方法[7]。
由于钯催化剂属于贵金属,不仅价格昂贵而且毒性较大,加上其在使用过程中极易形成颗粒微小的钯黑,造成产品的污染,因此如何在反应后有效地回收催化剂或者将其从反应体系中除去一直是有机化学家努力的方向之一。一种有效的方法是将金属钯催化剂以各种方式负载于无机或有机高分子载体上, 在合适的条件下,既能保持催化剂的活性,又有利于其在反应后的分离回收和重复利用。离子液体是一种绿色环保型溶剂,在离子液体中进行的Heck反应和Suzuki偶联反应也是研究得最多的碳—碳偶联反应之一。
3.三人获奖再次展示金属有机化学巨大的创造力
合成化学担负着创造新物质、新结构和新功能的首要任务,是化学科学的核心和基础,始终处于化学科学发展的前沿。2001年度诺贝尔化学奖获得主、名古屋大学教授、日本理化研究所理事长野依良治(R. Noyori)先生指出:化学是现代科学的中心,而合成化学则是化学的中心[8]。合成化学区别于其它学科的最显著特点就在于它具有强大的创造力,它不仅可以制造出自然界业已存在的物质,还可以创造出具有理想性质和功能的、自然界中不存在的新物质,合成化学通过与其它学科的交叉与融合,产生出了诸多跨学科前沿交叉新领域,为合成化学的发展提供了新的机遇,同时也对合成化学本身在不同时空尺度上提出了更高的要求,因此合成科学需要最高水平的科学创造力,以探索其无限的可能性。
事实上,“钯催化的交叉偶联反应”研究领域属于“导向有机合成的金属有机化学”(Organometallic Chemistry Directed Towards Organic Synthesis),此次诺贝尔化学奖授予这一领域的科学家,再次证明了原创性基础研究的重大意义,这不仅是有机合成方法学的重大突破,且具有广泛的实际应用价值,充分体现了科学研究中需要基础与应用结合、目标与方法并重的重要性。金属有机化学是有机化学与无机化学之间的交叉学科,主要研究“碳—金属”键、“氢—金属”键的形成、断裂与转化的规律。在诺贝尔化学奖百年历史上,已有17位金属有机化学家获奖。进入21世纪以来,有三次诺贝尔化学奖(2001年[9],2005年[10]和2010年)颁发给了9位从事该领域研究的科学家,这在诺贝尔化学奖史上是不多见的,也从一个侧面反映了金属有机化学在当今化学领域中的地位与贡献,彰显了金属有机化学这一领域的巨大创造力和活力[11]。
上世纪50年代二茂铁的发现、齐格勒-纳塔(Ziegler-Natta)催化剂的发明及其在聚烯烃工业上的成功应用,引发了聚烯烃材料工业的革命,也推动了金属有机化学研究进入一个全新和快速发展时期(1963年齐格勒(K. Ziegler)与纳塔(G. Natta), 1973年费歇尔(E. O. Fischer)与威尔金森(G. Wilkinson)分别被授予诺贝尔化学奖)。到80年代,“导向有机合成的金属有机化学”的概念被正式提出,自1981年“导向有机合成的金属有机化学”国际会议在美国科罗拉多州的科林斯堡首次举办以来,已历经30年、15届会议,现在会议规模达到千人左右,2011年“第16届IUPAC导向有机合成的金属有机化学”国际会议将在上海举行,这将是“导向有机合成的金属有机化学”发展历史上的一次盛会,也是此项国际会议首次在中国大陆举行,也从一个侧面反映了我国科学家在金属有机化学研究领域的可喜进步以及在该领域国际地位和影响力的提升。
4.以碳-氢键活化为基础的新一代物质转化
毫无疑问,三位科学家发展的碳—碳原子的偶联方法极大地促进了现代有机合成化学的发展,它不仅表现在对合成科学上的巨大贡献,而且这项技术已在全球的科研、医药开发与生产、发光材料和电子工业材料等领域得到广泛应用。包括除草剂氟磺隆(Prosulfuron)、非甾体抗炎镇痛药萘普生(Naproxen)、防晒剂对甲氧基肉桂酸辛酯、平喘药顺尔宁(Singulair)、抗真菌剂啶酰菌胺(Boscalid)以及电子封装材料Cyclotene?等在内的越来越多的医药制品、农药、精细化学品和有机材料的生产中使用了这些方法,一方面大大降低了生产成本,另外也减少了对环境的影响。不过我们也还必须看到这些方法的局限性,一个挑战性的问题是这些反应中均要使用卤代烃、硼酸酯及其衍生物等作为反应原料的一部分,但是这些原料绝大多数并不是自然界存在的或者容易人工合成的物质,另外在得到期望产物的同时,也还伴随有卤代物等盐类副产物的生成。
碳—氢化合物是有机物中最简单和常见的物质,基于碳—氢键活化策略的合成化学是最经济、简洁、高效和绿色的途径。因此,通过碳—氢键活化选择性地实现碳—碳原子或者碳-杂原子连接的合成方法,一直是化学家广泛关注的挑战性课题。但由于碳—氢键的键能高、极性小,因此活化困难、反应活性和选择性低,实现碳—氢键的活化、转化和选择性控制,一直被认为是化学中的“圣杯(Holy Grail)”之一[12]。值得欣喜的是,化学家的探索已经显示了这一梦想的可行性,并取得了一些突破性进展[13]。可以预见,在不远的将来,有机金属催化将使碳—氢键活化和选择性重组成为一种普遍的方法,人们将能够直接利用自然界本身存在的简单原料,通过直接转化,构筑我们丰富多彩的物质世界,那时的诺贝尔化学奖一定会授予那些在碳—氢键活化和选择性转化研究中做出卓越贡献的科学家。
参考文献
1. Heck R F, Nolley J P, J Org Chem 1972, 37: 2320~2322.
2.(a) Negishi E, King A O, Okukado N, J Org Chem 1977, 42: 1821~1823; (b) King A O, Okukado N, Negishi E, J Chem Soc Chem Commun 1977: 683~684.
3.(a) Miyaura N, Yamada K, Suzuki A, Tetrahedron Lett 1979, 20: 3437~3440; (b) Miyaura N, Suzuki A, J Chem Soc Chem Commun 1979: 866~867.
4. 殷元骐. 科学发展报告2003. 北京: 科学出版社, 64~67.
5. Wolfe J P, Singer R A, Yang B H, et al. J Am Chem Soc 1999, 121: 9550~9561.
6. (a) Sato Y, Sodeoka M, Shibasaki M, J Org Chem 1989, 54: 4738~4739; (b) Dounay A B, Overman L E, Chem Rev 2003, 103: 2945~2963.
7. (a) Uemura M, Nishimura H, Hayashi T, Tetrahedron Lett 1993, 34: 107~110; (b) Yin J, Buchwald S L, J Am Chem Soc 2000, 122: 12051~12052; (c) Genov M, Almorin P, Espinet P, Chem Eur J 2006, 12: 9346~9352; (d) Bermejo A, Ross A, Fernández R, et al. J Am Chem Soc 2008, 130: 15798~15799; (d) Uozumi Y, Matsuura Y, Arakawa T, et al. Angew Chem Int Ed 2009, 48: 2708~2710.
8. Noyori R, Nat Chem 2009, 1: 5~6.
9. 范青华, 王梅祥. 科学发展报告2002. 北京: 科学出版社, 41~43.
10.罗志斌, 丁奎岭, 戴立信. 科学发展报告2006. 北京: 科学出版社, 92~95.
11.丁奎岭, 陆熙炎. 科学, 2011, 63: xx~xx.
12.Arndtsen B A, Bergman R G, Mobley T A, et al. Acc Chem Res 1995, 28: 154~162.
13.(a) Fujiwara Y, Moritani I, Matsuda M, et al. Tetrahedron Lett 1968, 9: 3863~3865; (b) Murai S, Kakiuchi F, Sekine S, et al. Nature 1993, 366: 529~531; (c) Chen H, Schlecht S, Semple T C, et al. Science 2000, 287: 1995~1997; (d) Cho J -Y, Tse M K, Holmes D, et al. Science 2002, 295: 305~308; (e) Chen M S, White M C, Science 2007, 318: 783~787; (f) Wang D -H, Engle K M, Shi B-F, et al. Science 2010, 327: 315~319; (g) Chen M S, White M C, Science 2010, 327: 566~571.
附件下载:

