

上海有机所在免疫抑制剂萨菲菌素生物合成研究中取得进展
聚酮、聚肽及其杂合型天然产物是重要的药物来源,它们大多以聚酮合成酶(PKS)、非核糖体肽合成酶(NRPS)及其杂合装配线合成。通过对装配线底物起始单元或延伸单元的结构改变和优化,能够创造新结构、新活性的人工天然产物,为新药开发提供分子基础。因此,揭示装配线相关底物的生物合成逻辑,并探究关键酶作为生物催化工具的可能性具有重要的意义。
上海有机化学研究所刘文团队长期从事聚酮、聚肽类天然产物相关的装配线化学的研究,建立了高效、可靠的装配线化学研究方法,并深入揭示装配线上特殊的修饰蛋白招募机制、环化机制、糖苷单元形成机制、骨架编辑机制等新颖的装配线化学(J. Am. Chem. Soc. 2021, 143, 19719;Nat. Comm. 2021, 12, 3124;J. Am. Chem. Soc. 2022, 144, 14945;J. Am. Chem. Soc. 2023, 145, 5017;Nat. Chem. 2023, 15, 177)。基于前期的研究基础,刘文团队对免疫抑制剂萨菲菌素生物合成途径中装配线上特殊起始单元的形成和上载机制展开了研究。
萨菲菌素是由淡黄色链霉菌产生的聚酮-聚肽杂合型天然产物,其结构复杂,包含一个22元大环内脂和一个罕见的、手性中心密集的[5,5]螺内酰胺结构。萨菲菌素具有优异的免疫抑制活性,同时还具有抗病毒感染、抗心力衰竭等生物活性,具有良好的成药前景。2011年,刘文团队确定了萨菲菌素的生物合成基因簇,并揭示其由巨型的PKS-NRPS杂合装配线合成(Mol. Biosyst. 2011, 7, 852)。近期,他们通过详尽的体内外实验,进一步揭示了萨菲菌素装配线底物特殊起始单元新颖的形成和上载机制,该过程包含两步游离载体蛋白相关的酰胺化修饰和酰基转移反应,并首次发现了III型酮基合成酶(KAS-III)能催化起始单元的上载,相关工作在Angew. Chem. Int. Ed. 在线发表(DOI: 10.1002/anie.202217090)。
首先,通过生物信息学分析和基因敲除确定了天冬酰胺合成酶SfaP参与起始单元的酰胺化过程。但是,体外生化试验表明SfaP不能直接催化CoA底物的酰胺化,还需要游离载体蛋白SfaO才能完成酰胺化过程。具体而言,乙基丙二酰-CoA底物,首先需要转移到载体蛋白SfaO上;SfaP再通过ATP对其α-羧基进行活化形成AMP-偶联体,NH3再通过亲核取代与AMP交换,形成酰胺键。通过生物信息学分析和体外验证,发现载体蛋白依赖的酰胺化过程在自然界中广泛存在。对SfaP的底物谱进行了考察,发现其具有一定的底物宽泛性,对SfaO挂载的不同取代的丙二酰底物以及β-和γ-羧基底物都能识别。接下来,通过体外生化试验表明,KAS-III 同源蛋白SfaN催化可逆的酰基转移反应,完成起始单元2-乙基丙二酰胺从SfaO到ACPL的转移,实现起始单元的上载。SfaN具有较好的底物宽泛性,能够催化多种酰基底物从SfaO转移到ACPL转移,但是几乎不能识别α-羧基底物,对酰胺化过程表现出一定的门控作用。对SfaN的同源蛋白进行分析,发现多个基因簇中KAS-III 同源蛋白与游离的载体蛋白共同存在,表明其他体系中也可能采用相似策略,以KAS-III同源蛋白催化特殊装配线底物的上载。
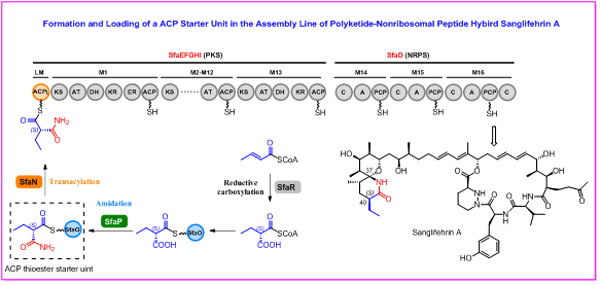
图1 萨菲菌素起特殊起始单元的形成和上载机制
上述研究中,我们揭示了免疫抑制剂萨菲菌素生物合成过程中特殊起始单元的形成和上载机制,证实了载体蛋白依赖的酰胺化过程以及KAS-III蛋白催化的起始单元上载过程,并建立了酰胺化酶和酰基转移酶的底物谱,为利用合成生物学创制萨菲菌素类似物提供了理论基础。上海有机所刘文团队汤志军博士、庞博博士和刘畅博士为本文的共同第一作者。该工作得到了国家自然科学基金委、科技部、上海有机所的大力资助。
附件下载:

