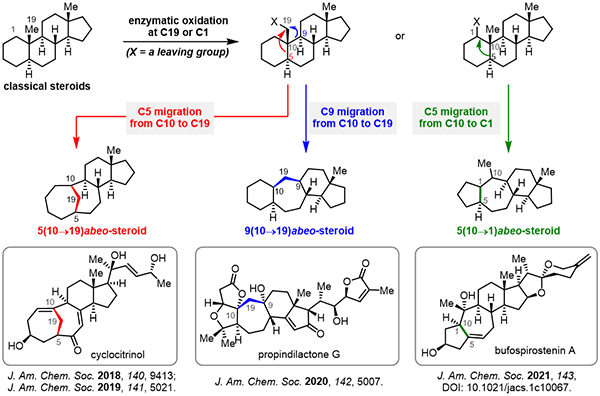
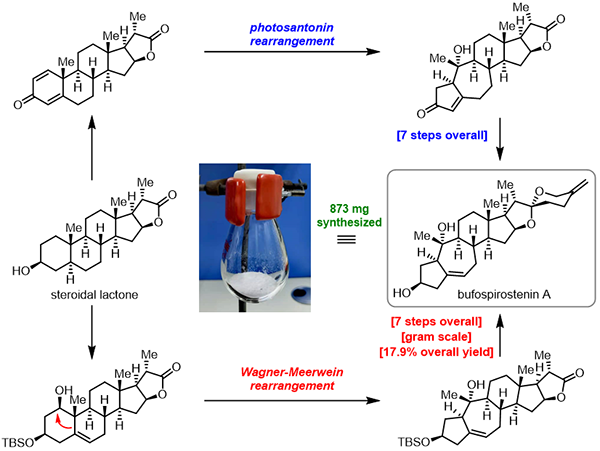
骨架重排甾体天然产物因其独特的环系结构以及潜在生理活性正得到越来越多的有机合成化学家的关注。中国科学院上海有机化学研究所天然产物有机合成化学重点实验室桂敬汉课题组一直致力于甾体和萜类天然产物的高效合成。基于骨架可控性重组的仿生合成策略,他们先后于2018年完成了重排甾体天然产物cyclocitrinols的合成(J. Am. Chem. Soc. 2018, 140, 9413–9416;J. Am. Chem. Soc. 2019, 141, 5021–5033),于2020年完成了天然产物propindilactone G的合成(J. Am. Chem. Soc. 2020, 142, 5007–5012)。近期,基于此合成策略,他们以廉价易得的甾体内酯为原料,分别以总计7步和9步反应完成了甾体天然产物bufospirostenin A的两种仿生合成,并实现了该天然产物的克级规模制备(J. Am. Chem. Soc. 2021, 143, DOI: 10.1021/jacs.1c10067)。
图1 基于骨架可控性重组的天然产物仿生合成
Bufospirostenin A是由暨南大学叶文才团队于2017年从中华大蟾蜍(toad Bufo bufo gargarizans)的胆汁中分离得到的具有5/7/6/5/5/6六环骨架和10个连续手性中心的复杂甾体天然产物。初步研究表明该天然产物在12.5和25 μM的浓度下对ATP酶分别有着21%和43%的抑制活性,然而仅有1.9 mg的样品被分离得到。目前该分子仅有一例全合成报道。2020年,南方科技大学的李闯创课题组通过Rh催化的分子内Pauson-Khand反应完成了该天然产物的首次全合成(J. Am. Chem. Soc. 2020, 142, 12602)。
桂敬汉团队首先提出了两种可能的生源合成途径,他们认为天然产物中的5/7稠环结构有可能是由经典的甾体6/6稠环结构通过山道年重排或者Wagner-Meerwein重排转化得到。随后,从同一廉价易得的甾体内酯原料出发,他们进一步发展了基于光照山道年重排和Wagner-Meerwein重排的两种不同的仿生合成路线完成了bufospirostenin A的合成。值得一提的是,克级规模的山道年重排路线可一次性得到873 mg的天然产物,为相关的生物活性研究提供了足够的样品。他们通过化学合成的手段实现了这两种生源转化,从而为bufospirostenin A可能的生源合成假设提供了实验支持。
图2 天然产物Bufospirostenin A的克级规模仿生合成
上述工作主要由王宇博士完成。该研究工作得到了国家自然科学基金委、上海市科委和国家中医药管理局的资助。