

上海有机所在过渡金属催化的环己二烯酮的去对称化反应研究中取得重要进展
手性的顺式氢化苯并呋喃骨架广泛存在于天然产物中,对环己二烯酮催化的不对称去对称化反应是构建这个骨架最直接和高效的方法之一。目前主要通过有机催化的分子内的Stetter反应和分子内的Rauhut-Currier反应来实现,但均具有较大的底物局限性。
近期,中科院上海有机所天然产物有机合成化学院重点实验室林国强课题组利用铑催化串联的芳铑化/共轭加成反应成功实现了对环己二烯酮的不对称去对称化。该方法在较温和的条件下,以高收率(最高达99%)和高对映选择性(最高达99% ee)得到了芳化环化产物,环化产物经过两步简单的转化就可得到三个相应的重要骨架(Angew. Chem., Int. Ed.2013,52, 5314)。该工作首次将铑催化的1,6-烯炔的环化反应提高到一个新的高度。
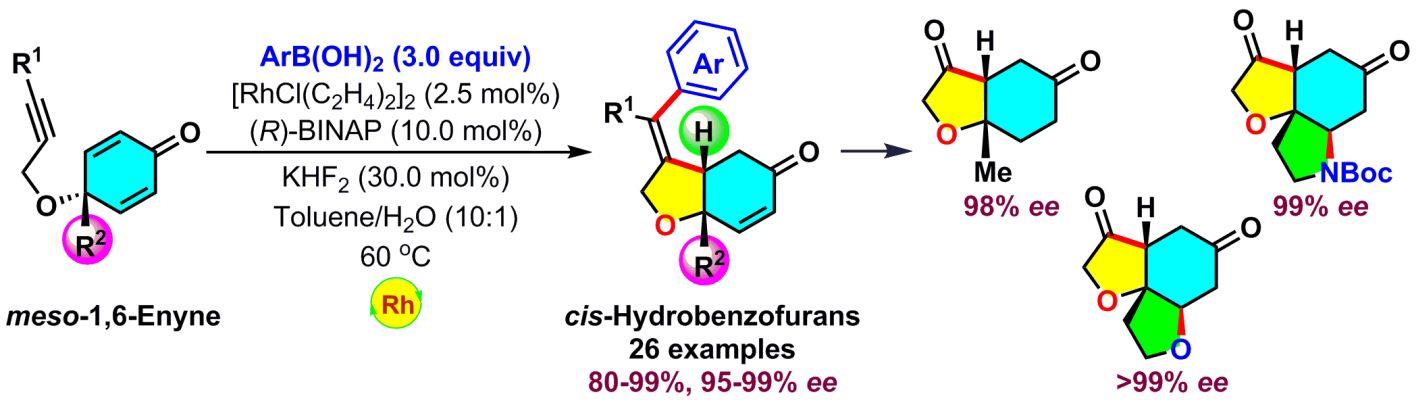
铑催化的1,6-烯炔的不对称芳化环化反应
随后,该课题组又实现了非贵金属铜催化的含有环己二烯酮的1,6-烯炔的不对称硼化环化反应。该反应以优异的区域选择性和对映选择性得到了含有烯基硼酸酯和烯酮结构的顺式氢化苯并呋喃骨架。进而双环产物经简单的转化就可分别得到桥环和三环骨架(J. Am. Chem. Soc.2013,135, 11700)。该方法拓宽了铜催化的联硼酸酯的不对称串联反应。
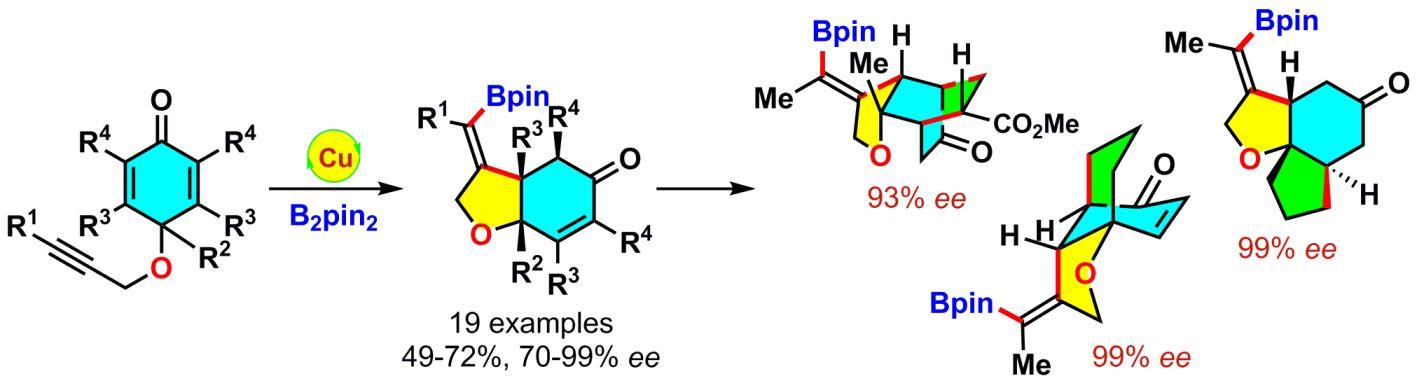
铜催化的1,6-烯炔的不对称硼化环化反应


 最近,该课题组成功地实现了三价铑催化的N-甲氧基以及N-特戊酰基氧苯甲酰胺和1,6-烯炔的可调控的芳化环化反应。首先,苯甲酰胺和1,6-烯炔在三价铑的催化下,通过C(sp2)?H活化形成一个七元铑环中间体。当R为特戊酰基时,七元铑环中间体马上发生碳-氮还原消除以及氮-氧氧化加成的过程而生成异喹啉,异喹啉再发生氮杂Michael加成反应而构建了一个四环产物;另一方面,当R为甲氧基时,七元铑环中间体则不经历一个碳-氮还原消除的历程而直接经过碳-Michael加成反应而得到一个三环产物(J. Am. Chem. Soc.2014,136, 15607)。此外,通过对机理的仔细研究揭示了碳氢活化依然是这两个串联反应的决速步骤。
最近,该课题组成功地实现了三价铑催化的N-甲氧基以及N-特戊酰基氧苯甲酰胺和1,6-烯炔的可调控的芳化环化反应。首先,苯甲酰胺和1,6-烯炔在三价铑的催化下,通过C(sp2)?H活化形成一个七元铑环中间体。当R为特戊酰基时,七元铑环中间体马上发生碳-氮还原消除以及氮-氧氧化加成的过程而生成异喹啉,异喹啉再发生氮杂Michael加成反应而构建了一个四环产物;另一方面,当R为甲氧基时,七元铑环中间体则不经历一个碳-氮还原消除的历程而直接经过碳-Michael加成反应而得到一个三环产物(J. Am. Chem. Soc.2014,136, 15607)。此外,通过对机理的仔细研究揭示了碳氢活化依然是这两个串联反应的决速步骤。
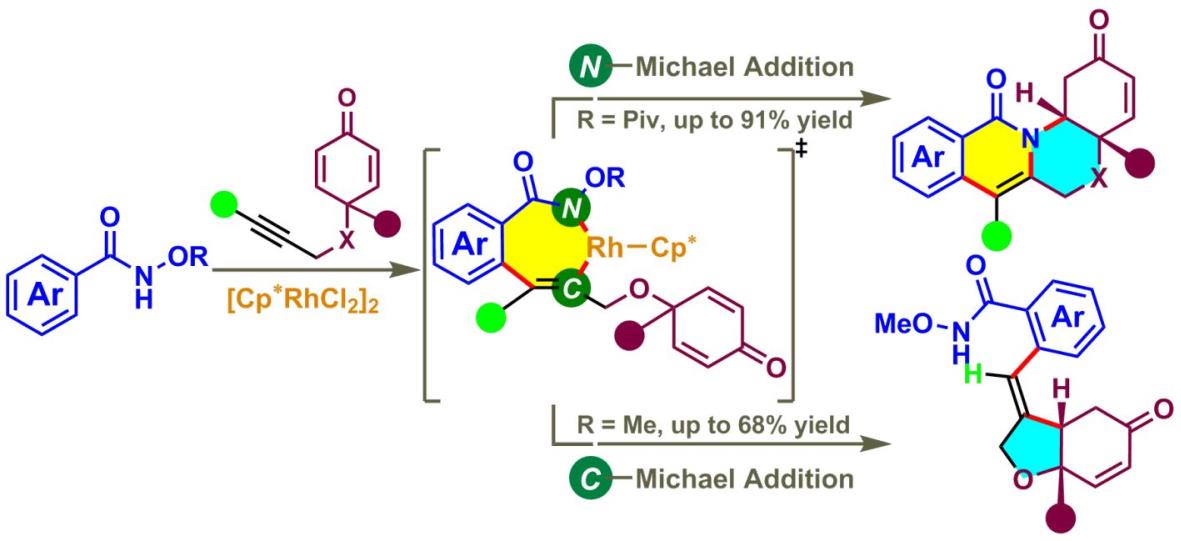
由铑催化的碳氢活化所触发的可调控的1,6-烯炔的芳化环化反应
上述研究得到了国家自然科学基金委、科技部、中国科学院和上海市科委的大力资助。
附件下载:

