

上海有机所在手性螺环天然产物的形成和修饰研究方面获重要发现
阿维菌素(Avermectins,AVEs)是一类产生于除虫链霉菌、包含8个天然组分的16元大环内酯类抗生素。具有相似骨架的抗生素还包括米尔倍霉素(Milbemycins,MILs)、梅岭霉素(Meilingmycins,MEIs)和奈马克丁(Nemadectins,NEMs),结构上均拥有一个与大环内酯偶联的特征性6,6-螺环单元。这类天然产物的发现,是抗虫药物发展历史上的一个重要里程碑。阿维菌素选择性作用于线虫细胞的氯离子通道,对人畜毒副作用低,在家畜寄生虫感染的治疗和农业病虫害防治方面均有广泛的应用;特别是其22,23-位发生氢化的衍生物伊维菌素,被认为是过去30年间用于人畜卫生保健最为成功的抗虫药物之一。
阿维菌素的生物合成研究始于20年前。大量的前期研究数据表明,一组复杂的I型聚酮合成酶负责了糖苷部分碳链骨架的构建;随后,包括氧化还原、糖基转移等一系列化学反应形成了成熟的活性分子。但是,关于其特征性的6,6-螺环单元合成的分子机制一直不清楚:是否存在特定的酶催化了单一构象的螺环形成?催化螺环上22,23-位的脱水反应、决定“a”和“b”系列组分走向的控制因素是什么?这一基础科学问题也长期困扰了工业用阿维菌素生产菌株的生物技术改造,如何简化组分构成、提高有效成分的比例缺乏可信赖的理论依据。
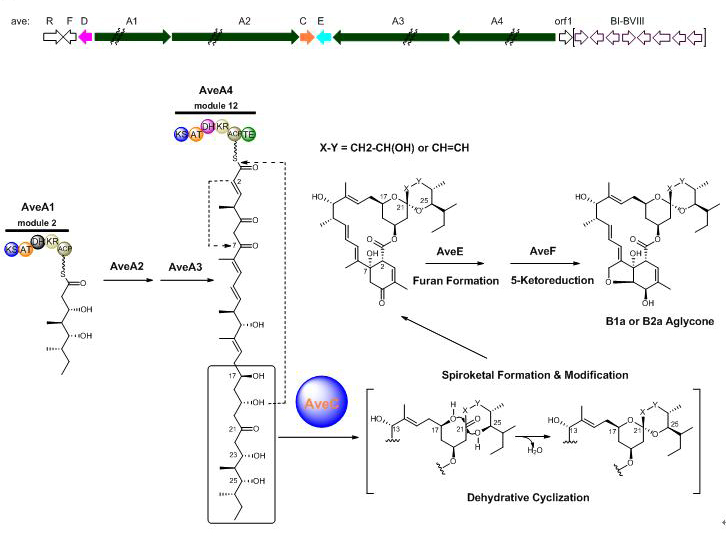
上海有机所生命有机化学国家重点实验室刘文课题组孙鹏博士、赵群飞副研究员等经过艰苦努力,最近解开了这个谜团(J. Am. Chem. Soc. 2013, 135, 1540-1548)。他们从分离入手,表征了极不稳定的中间产物,阐明了以C17,C25-双羟基-C21-酮基的线性基团是6,6-螺环的直接前体;尤其是结合大量的体内和体外实验,发现了一个具有双重功能的新型蛋白AveC,负责6,6-螺环单元的形成和修饰。首先,AveC是一个螺环合成酶,它以底物C21-位的酮基为中心,通过脱水环化立体专一性地催化了单一R-构型的6,6-螺环单元生成。在缺乏该酶活性的条件下,不稳定的中间产物将发生自发环化,形成S-和R-两种构型的产物,而S-构型的类似螺环化合物在自然界中并不存在。其次,AveC还是一个脱水酶,区域选择性地催化C23-位羟基的脱除并在C22-C23位形成双键。值得注意的是,AveC的脱水活性和螺环合成活性既相互独立,又相互竞争同一个线性前体。其螺环合成活性显然具有较高的容忍性,能够同时接受C23-为羟基和C22-C23位为双键的两种底物,从而催化形成6,6-螺环单元上存在不同修饰的两种产物。这是阿维菌素“a”和“b”系列组分产生的根源所在。
AveC螺环形成和脱水双重功能的揭示具有重要的理论研究价值。阿维菌素的结构类似物米尔倍霉素、梅岭霉素和奈马克丁的生物合成中均具有与AveC同源的蛋白负责6,6-螺环单元的合成;不同的是,这些同源蛋白丧失了脱水活性,后者的功能转而由I型聚酮合成酶的脱水结构域所替代、发生在碳链骨架聚合的过程中。抗生素Reveromycin的生物合成中也存在一个螺环合成酶RevJ,以相同的分子机制负责单一手性的6,6-螺环单元合成;然而,RevJ和上述AveC类蛋白在氨基酸序列上却没有任何同源性。这一有趣的现象表明,螺环合成酶在立体专一性控制螺环天然产物的形成方面具有普遍意义,其功能的进化是受分子结构的驱动而非以序列的同源性为基础。
阿维菌素螺环形成和修饰的分子机制的发现具有重要的潜在应用研究价值。刘文课题组在此基础上,采用蛋白进化技术调控了AveC的脱水活性,结合前期的代谢途径遗传修饰改造,实现了阿维菌素某单一活性组分的制备。所构建的重组菌株在“中国科学院上海有机化学研究所湖州生物制造产业创新中心”进行了优化和放大,达到了产业化生产的要求,并转让至国内阿维菌素产品的主要生产厂家之一——浙江升华拜克药业公司(目前,该公司正就阿维菌素单组份作为农用杀虫抗生素药物进行申报)。如能顺利投产,将是单组份生物农药工业化生产和使用的重要突破,在生产工艺简化、产品品质优化以及减少有机试剂使用和缓解与之相关的环境污染等方面具有广阔的前景。
上述研究成果受到国家自然科学基金委、科技部、上海市科委和中国科学院的大力资助。
附件下载:

