

上海有机所在甲基化关键蛋白UHRF1识别组蛋白H3R2的分子机制研究方面取得进展
随着研究的深入,科学家发现DNA序列不是唯一的遗传信息,除了基因组DNA外,还有大量遗传学信息调控着基因的表达,称之为表观遗传信息。表观遗传是指DNA序列不发生变化的情况下,基因表达却发生了可遗传的改变。这种改变是细胞内除了遗传信息以外的其他可遗传物质发生的改变,且这种改变在发育和细胞增殖过程中能稳定传递。表观遗传信息与基因序列本身一样重要,因为它控制着基因是否被开启或关闭,从而决定他们是否制造蛋白质。在过去的几十年里,研究人员已经知道DNA甲基化作用是这些标记基因沉默的表观遗传修饰过程中的其中一种类型,这种修饰导致靶标基因不能生产蛋白质。此外还有一种修饰叫做组蛋白甲基化作用,该反应是标记包裹DNA的组蛋白。
UHRF1是一种核蛋白,对保持DNA的甲基化状态及表观修饰的遗传起着重要作用。它含有五个已知的功能域,包括N-端的UBL结构域、串联的Tudor结构域、PHD结构域、SRA结构域、以及C-末端的RING结构域。UHRF1的多个功能域赋予它功能上的多样性,能够与多个蛋白相互作用,从而将DNA甲基化、组蛋白甲基化、组蛋白乙酰化、组蛋白泛素化、染色质形态等多种表观遗传修饰联系了起来,因此成为几年来分子生物学、结构生物学等领域研究的热点。UHRF1的表达水平在很多肿瘤细胞中显著增加,在散发性乳腺癌组织细胞中,UHRF1的过量表达可以导致抑癌基因BRCA1启动子区域的表观遗传发生改变,包括DNA甲基化、组蛋白修饰、染色质重组、以及转录抑制复合物的招募,最终导致BRCA1基因的沉默。与经典的PHD结构域的不同,PHDUHRF1的氨基末端含有额外的半胱氨酸,可与Zn离子结合形成锌指。之前有研究表明,PHDUHRF1能够介导UHRF1特异性结合K9-三甲基化的H3 尾部肽段(H3K9me3),然而最近的研究表明,Tudor结构域介导着UHRF1与K9-三甲基化的H3 尾部肽段的结合特异性。因此研究PHDUHRF1与组蛋白H3的复合物结构及其功能将大大促进人们了解甲基化的调控过程、癌症背后的表观遗传学机制以及帮助设计出合适的药物。
上海有机所生命有机化学国家重点实验室的曹春阳研究员课题组利用NMR手段分别解析了UHRF1的PHD结构域与未修饰H3 N-端尾部肽段(H3K9me0)以及与9-位赖氨酸三甲基化修饰的H3 尾部肽段(H3K9me3)的两种复合物溶液三维结构,发现H3R2而不是H3K9介导了UHRF1的PHD结构域与H3 尾部的作用,同时该识别模式与现有已经报道的H3R2识别相比明显不同,是一种新的识别模式。这一结论又进一步得到了核磁滴定实验、定点突变实验、色氨酸荧光光谱实验等验证。核磁滴定实验表明,当R2进行对称或不对称双甲基化修饰时,PHDUHRF1的1H,15N -HSQC谱图与结合未修饰H3肽段时相比,交叉峰的化学位移变化很大,而当K9或K4甲基化修饰时,PHDUHRF1的1H,15N-HSQC谱图与结合未修饰H3肽段时相比,交叉峰的化学位移基本没有变化。荧光光谱实验表明,H3R2的双甲基化使PHDUHRF1结合H3多肽的能力降低十多倍,而H3K4及H3K9甲基化则基本不影响PHDUHRF1对H3多肽的结合。另外,将H3R2或PHDUHRF1中与R2相互作用的关键残基D347、D350进行突变,发现当R2或D347突变为A(丙氨酸)后,几乎完全破坏了PHDUHRF1与未修饰的H3多肽的结合;D350突变为A之后,PHDUHRF1与未修饰的H3多肽结合能力也有明显下降。结合复合物三维结构及以上生化数据,我们可以确定PHDUHRF1主要通过D347和D350特异性识别未甲基化修饰的H3R2来结合H3 N-端尾部肽段。该项研究结果发表于Cell Research, 2011 21, (9), 1379-1382。
在该项研究结果发表的同时,复旦大学徐彦辉教授、哈佛大学Yang Shi教授联合Sloan Cancer Institute的Patel教授分别在Cell Res和Mol Cell发表类似研究结果,香港大学钱成明教授、法国Lallous教授也分别在PloS One和J Mol Biol发表类似结果。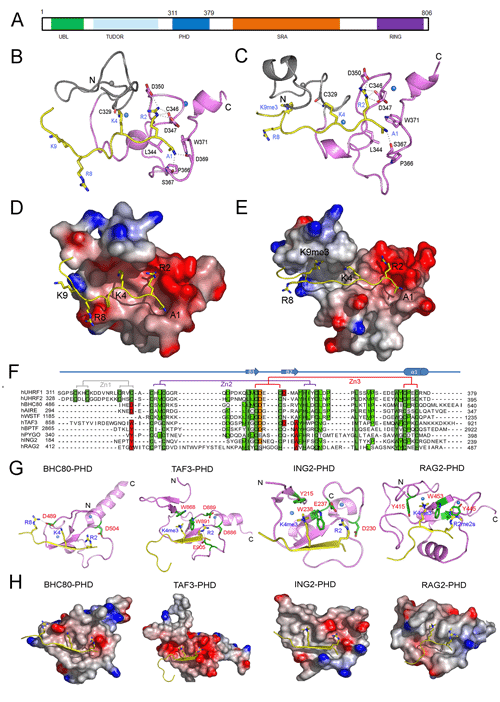
图1: PHDUHRF1识别未修饰的H3R2结构生物学基础
本项目得到了中国科学院、科技部、国家自然科学基金和上海市的资助。
附件下载:

