

上海有机所交叉中心揭示亚精胺调控RIPK1乙酰羟丁胺化修饰抑制糖尿病的发生及其并发症的分子机理
已知N-乙酰基转移酶基因NAT2调控人类2型糖尿病的胰岛素敏感性,但其中的机制并不清楚。近来hNAT2被发现能够乙酰化内源性的天然多胺,包括腐胺和亚精胺。亚精胺一直以来被认为具有抗炎、抗衰老的保健作用,可以预防各种与衰老相关的疾病,包括保护心血管系统、神经系统,维持肠道屏障完整性以及延长寿命,但对其中分子机制也一直不清楚。2024年11月7日,中国科学院上海有机化学研究所生物与化学交叉研究中心袁钧瑛实验室在Nature Cell Biology杂志在线发表了题为“Spermidine mediates acetylhypusination of RIPK1 to suppress diabetes onset and progression”的研究论文,报道了亚精胺介导RIPK1乙酰羟丁胺(acetylhypusination)修饰的分子机制,揭示了NAT1敲除促进RIPK1激活及血管内皮细胞死亡而导致糖尿病的发生,运用亚精胺和RIPK1抑制剂能够抑制糖尿病的发生及其并发症的发展。RIPK1是炎症和细胞死亡的关键调节因子。RIPK1的激活和与人类炎症性疾病和神经退行性疾病密切相关,RIPK1抑制剂已在进行包括治疗多种炎症和神经退行性疾病在内的多个人体临床实验。袁钧瑛实验室的前期研究证明,hNAT2表达水平在阿尔兹海默症病人的脑小血管内皮细胞中下降,而且mNAT1缺失促进脑血管内皮细胞RIPK1激活及细胞死亡,加重阿尔兹海默症小鼠模型的认知缺失。袁钧瑛实验室的新成果提示,可运用亚精胺和RIPK1抑制剂来减少衰老过程中的炎症以及治疗糖尿病和阿尔兹海默症中的小血管内皮细胞损伤,为预防和治疗衰老相关的人类重大疾病提出了新方向。
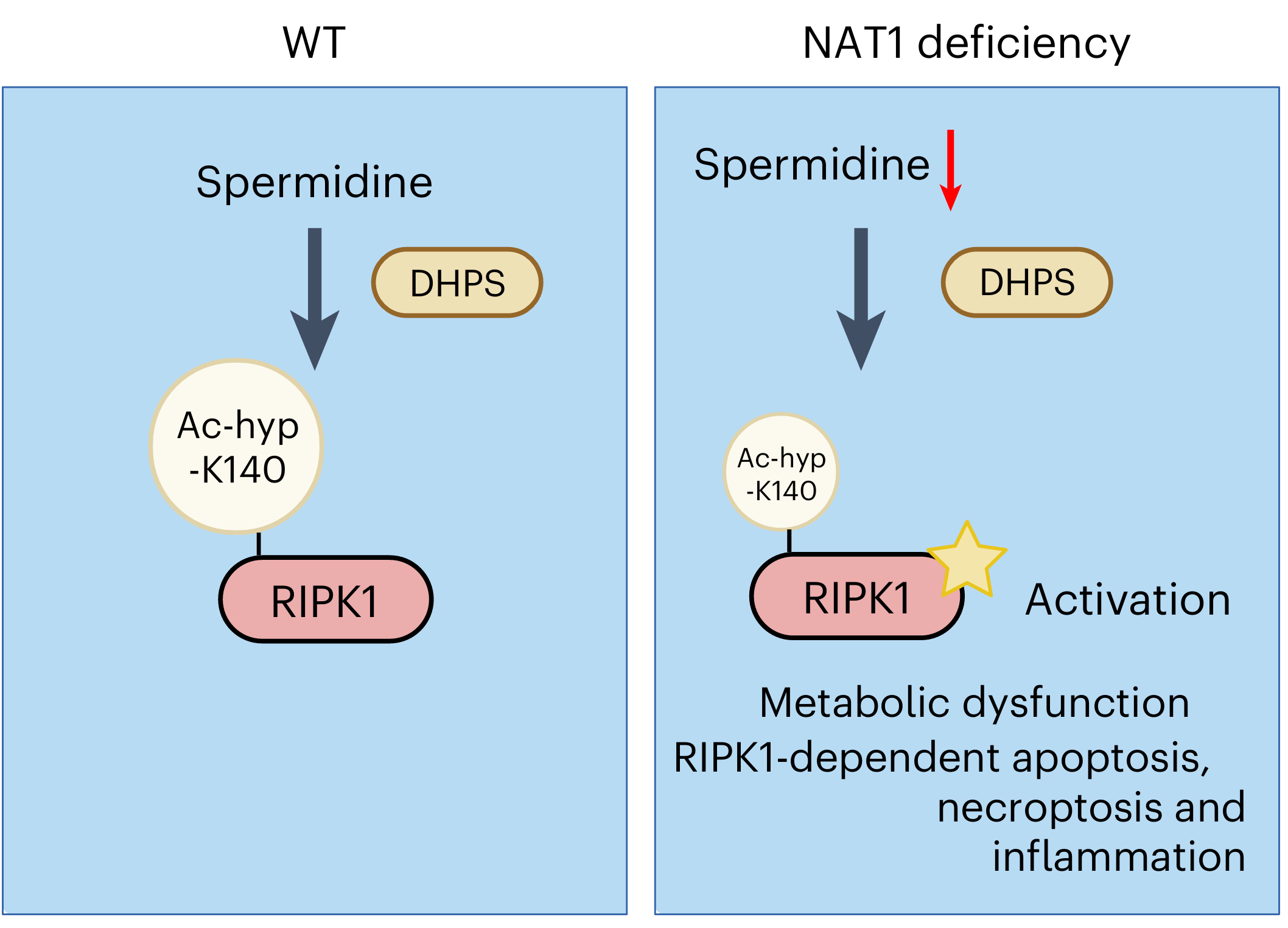
图1 亚精胺介导的acetylhypusination修饰抑制RIPK1激活
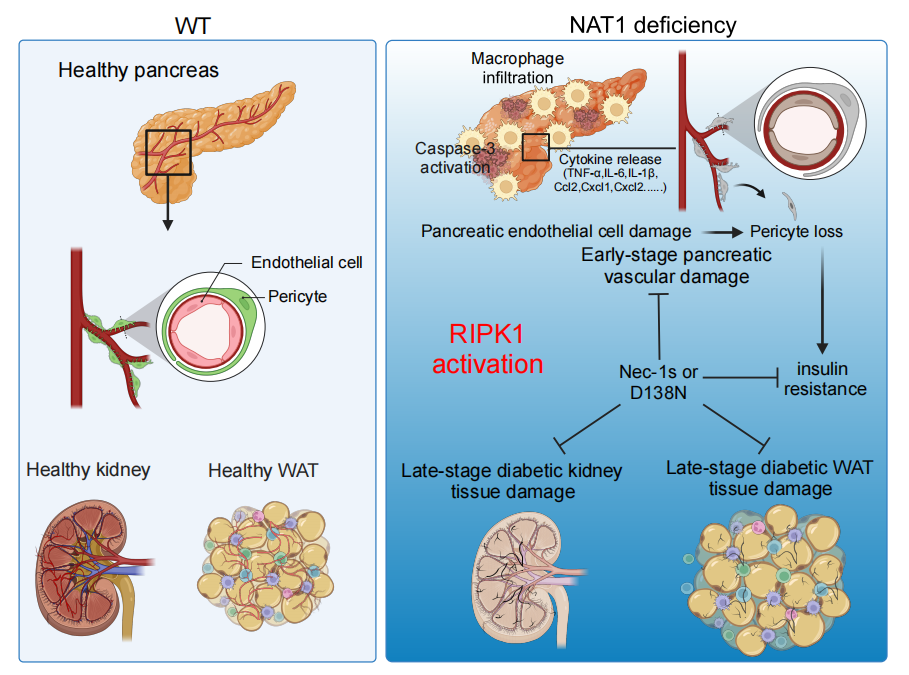
图2 Nat1条件性敲除小鼠引起血管炎症诱导的胰岛素抵抗和糖尿病肾病表型可以通过抑制RIPK1激酶活性来阻断
2型糖尿病是21世纪增长最快的全球健康挑战。中国糖尿病的发病率30年来增加了12倍,目前中国人口的12%患有糖尿病,这个数字预计将继续呈快速增长态势,成为影响中国人民健康和国家经济发展的沉重负担。2型糖尿病是一种以胰岛素抵抗为特征的代谢紊乱。目前对早期2型糖尿病的治疗手段比较多,主要集中在控制高血糖症上。但是,单一控糖并不能免除糖尿病的进展。目前对2型糖尿病是如何从早期到晚期转化并不清楚。糖尿病晚期会出现严重的血管损伤,常见的并发症包括眼底出血造成的眼睛失明,肾血管损伤造成的肾功能衰竭。目前对肾功能衰竭的主要治疗方法是肾透析和肾移植。发现糖尿病发生和发展的基础科学机制是开发治疗糖尿病新方法的关键。我们的这项研究发现RIPK1介导的血管内皮细胞死亡和炎症对糖尿病的发生和发展起到了重要的作用,可以直接诱导2型糖尿病的发病,促进糖尿病血管并发症的发展以及出现类似糖尿病患者终末期难以治疗的肾损伤,提示了RIPK1是治疗代谢紊乱、糖尿病及终末期血管损伤并发症的重要靶点,为深入研究糖尿病的机理和开发新的治疗手段提供了重要的新思路。
该论文的通讯作者是中国科学院上海有机化学研究所生物与化学交叉研究中心主任袁钧瑛院士、单冰副研究员和朱正江研究员,第一作者是中国科学院上海有机化学研究所生物与化学交叉研究中心张天博士。中国科学院上海有机化学研究所生物与化学交叉研究中心张耀阳研究员、王召印研究员和胡军浩研究员以及上海交通大学医学院附属仁济医院李佩盈研究员和上海交通大学医学院附属第六人民医院刘军力研究员等人提供了宝贵的帮助。
该工作受到了国家自然科学基金委,中国科学院和上海市科委的大力资助。
附件下载:

