

上海有机所在arcutine家族二萜生物碱的合成研究中取得进展
二萜生物碱具有复杂而精巧的骨架结构,并显示出抗炎、镇痛、调整心律失常等多种生物活性,因此数十年来受到合成化学家的密切关注。Arcutine家族生物碱是一类骨架结构颇为特殊的C20二萜生物碱。与绝大多数具有C10-C20键连方式的C20二萜生物碱不同,arcutine类生物碱具有C5-C20的键连方式。从生源角度看,arcutine骨架可能由hetidine骨架经历碳正离子型的1,2-烷基迁移过程而形成 (图1)。王锋鹏和梁晓天以及Sarpong等分别提出了与此过程相关的生源假说,对该类骨架的化学合成颇具启发性。最近,秦勇等和Sarpong等先后报道了arcutine家族成员的全合成。
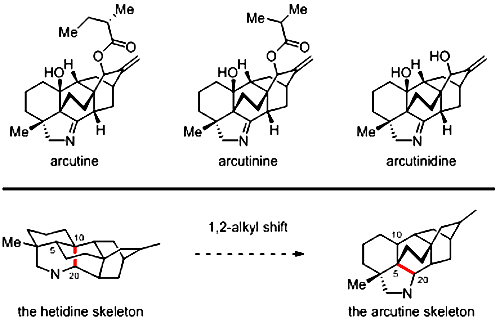
图1. Arcutine家族代表性成员的结构以及hetidine骨架和arcutine骨架之间的生源关系
中国科学院上海有机化学研究所生命有机化学国家重点实验室李昂课题组的周述鹏博士和夏开富与金属有机化学国家重点实验室的冷雪冰博士合作,报道了三个arcutine类生物碱的不对称全合成 (J. Am. Chem. Soc. doi: 10.1021/jacs.9b05818)。核心策略是利用Prins反应生成的碳正离子引发1,2-烷基迁移,从而实现从hetidine骨架到arcutine骨架的转化 (图2)。在此策略的指导下,李昂等结合前期关于hetidine类生物碱的合成经验 (J. Am. Chem. Soc. 2018,29, 9025),首先发展了一条制备hetidine家族核心骨架的便捷路线,关键步骤包括路易斯酸促进的分子间Diels-Alder反应和二烯醇负离子参与的分子内Diels-Alder反应。在以克级规模制得五环中间体1之后,他们利用SnCl4活化该分子中的MOM基团,引发Prins环化反应,进而启动Wagner-Meerwein类型的1,2-烷基迁移,最终获得具有arcutine核心结构的化合物2。该中间体经过进一步官能化修饰即转化为arcutinidine、arcutinine和arcutine。在前期研究中,李昂课题组发展了Prins环化策略用以构建拥挤环系,实现了indotertine、sespenine、hapalindoles、taiwaniadduct D、epoxyeujindole A、aflavazole等不同类型天然产物的全合成。此项工作既为Prins环化策略的合成应用增添了一个生动的实例,又为arcutine类生物碱的生源假说提供了有力的佐证。
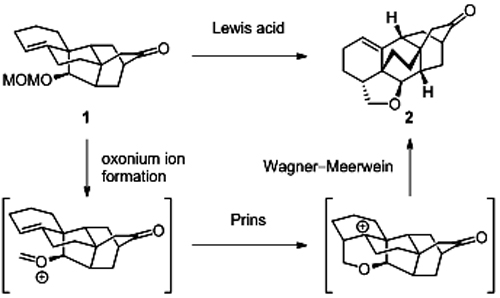
图2. 将hetidine骨架转化为arcutine骨架的Prins/Wagner-Meerwein串联反应
上述研究受到了中国科学院战略性先导科技专项 (B类) 和国家杰出青年科学基金等项目以及分子合成科学卓越创新中心的支持。
附件下载:

