

上海有机所在肌球蛋白分子马达Myosin VI结合Tom1和自噬受体蛋白促进自噬体成熟的分子机制方面取得新进展
细胞自噬(autophagy)是真核细胞内一种必不可少且高度受调控的,利用溶酶体来清除大型蛋白聚集体、受损细胞器、入侵病原体等成分以应对内外界细胞压力和维持细胞动态平衡的重要分解代谢过程。细胞自噬在细胞生长、胚胎发育、天然免疫等众多生理过程中扮演着重要的角色。Myosin VI是真核细胞内唯一一个沿着微丝反向运输(从微丝正端向负端运输)的非经典的肌球蛋白分子马达,在细胞自噬和内吞途径等众多的细胞过程中扮演着重要的角色,其功能的缺失或异常与大量的人类疾病相关联,例如,肥厚性心肌病、宫颈癌、前列腺癌症、耳聋、脑星形胶质细胞增多症等。在自噬过程中,Myosin VI可以通过结合内吞体相关蛋白Tom1以及自噬受体蛋白TAX1BP1、NDP52和Optineurin,介导内吞体和自噬体的融合,并促进自噬体的成熟。然而,由于缺乏详细的机制研究,Myosin VI如何精准地识别Tom1,两者的结合模式又是怎样?Myosin VI是怎样通过与Tom1以及自噬受体蛋白的结合从而促进自噬体和内吞体的融合?这些问题目前还尚不清楚。
近期,中科院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究组发表了题为“Myosin VI/Tom1的复合物结构揭示了一种用于锚定的肌球蛋白Myosin VI的货物蛋白识别模式”的研究论文(Nature Communications. 2019, 10(1):3459)。在该研究中,团队成员首先开展了大量的生化实验,确认了Tom1和Myosin VI羧基末端CBD结构域发生相互作用的结合区域,然后成功地获得了Myosin VI的羧基末端CBD结构域结合Tom1的复合物的高分辨晶体结构。与生化实验结果相一致,在解析的晶体结构中Myosin VI和Tom1采取了特殊的1:1化学计量比的结合模式。由于Myosin VI羧基末端CBD结构域过去还被报道可以结合Dab2,而Dab2的结合会诱导Myosin VI形成二聚体,从而发挥其行走的功能。通过详细比较Myosin VI/Tom1和Myosin VI/Dab2的复合物结构,并结合相关的NMR和ITC实验,进一步证实Tom1的结合不会诱导Myosin VI发生二聚或寡聚。因此,不同于目前已知的货物蛋白结合诱导Myosin VI形成二聚体或寡聚体,从而发挥Myosin VI连续行走功能的结合模式,该研究解析的Myosin VI/Tom1的复合物晶体结构揭示了Myosin VI一种新的货物蛋白结合模式:货物蛋白结合后Myosin VI仍然以单体形式存在,从而发挥其锚定和捆绑的功能。
接着,该团队通过NMR实验证实紧邻羧基末端CBD结构域的Myosin VI的RRL模序区域可以识别自噬受体蛋白TAX1BP1、NDP52和Optineurin,但三者结合Myosin VI的模式不完全一致。进一步的免疫共沉淀实验表明,Myosin VI可以作为桥联蛋白,同时与Tom1和这些自噬受体蛋白发生相互作用,并形成三元复合物。有趣的是,虽然细胞内实验能检测到Myosin VI和自噬受体蛋白的结合,但各类体外实验都表明,两者结合的亲合力非常弱,无法形成稳定的复合物。后续的体外研究表明在Myosin VI/Tom1/自噬受体蛋白三元体系中加入多聚泛素链蛋白后,通过分析型凝胶色谱层析可以分离得到稳定的Myosin VI/Tom1/自噬受体蛋白/多聚泛素链的四元复合物。这表明泛素链可以进一步促进和稳定Myosin VI/Tom1/自噬受体蛋白复合物的形成,从而利于后续内吞体和自噬体的融合过程。最后,该研究描绘出Myosin VI协同Tom1,相关泛素链和自噬受体蛋白来介导内吞体和自噬体的融合,进而促进自噬体成熟的机制模型图。总之,此项研究首次报道了Myosin VI羧基末端CBD结构域和Tom1的复合物的高分辨率晶体结构,揭示了Myosin VI和Tom1之间独特的结合模式,并完善了Myosin VI协同Tom1,泛素蛋白和自噬受体蛋白TAX1BP1、 NDP52或Optineurin来介导内吞体和自噬体的融合,进而促进自噬体成熟的分子机制。
潘李锋课题组的胡世尘博士为本文的第一作者,上述研究工作得到国家自然科学基金委,科技部,中科院和生命有机化学国家重点实验室的资助。
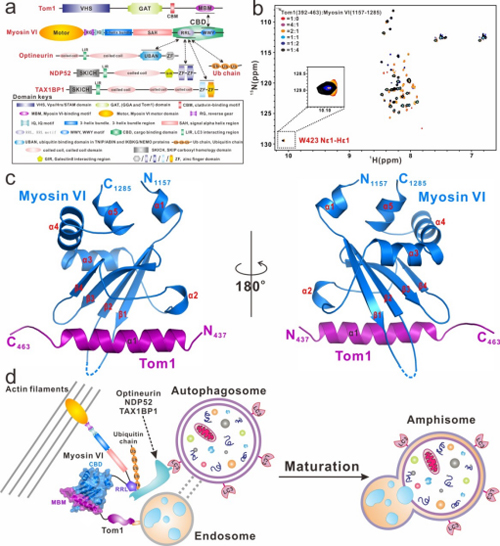
图1. 肌球蛋白Myosin VI结合Tom1和相关自噬受体蛋白促进自噬体成熟的分子机制
附件下载:

