

上海有机所硫肽类抗生素的生物合成研究取得重要进展
许多具有生物活性的肽类天然产物都拥有羧基末端酰胺化的结构。酰胺的形成一般由天门冬氨酸合成酶类蛋白所催化,其过程包括以谷氨酰胺为底物原位生成氨,后者进攻由ATP活化的羧基基团而产生酰胺并伴随谷氨酸、AMP和PPi的释放。此外,很多动物激素的末端酰胺形成则包含一个二价金属离子依赖的氧化过程,通过羧基端延伸的甘氨酸残基Cα-位上羟基的引入而去烷基化,生成酰胺并释放乙醛酸。与上述两种常见的方式明显不同,中科院上海有机化学研究所生命有机国家重点实验室的研究人员,在硫肽类抗生素的生物合成途径中发现了一种内源性、非氧化的新型酰胺化形成机制。
硫肽类抗生素是一类富含元素硫、结构被高度修饰的聚肽类天然产物,所有的成员都具有一个以6元杂环为核心、由多个5元杂环和脱水氨基酸所组成的环肽结构。大多数硫肽类抗生素具有良好的抗菌活性,其中部分成员对多种耐药性的条件致病菌具有极强的杀伤效果。上海有机所的研究人员近期揭示了硫肽生源途径的共同特点,即以一条核糖体来源的前体肽(NosM)为底物,经过保守的翻译后修饰而形成特征性的框架结构(Chem. Biol. 2009, 16, 141; ACS Chem. Biol. 2009, 4, 855; Mol. BioSyst. 2010, 6, 1180)。这一发现引起了广泛的关注和兴趣(亮点评述:SciBX. 2009, 2(10), DOI: 10.1038/SciBX.2009.423; Angew. Chem. Ind. Ed. 2009, 48, 6770; Nat. Prod. Rep. 2010, 27, 153)。
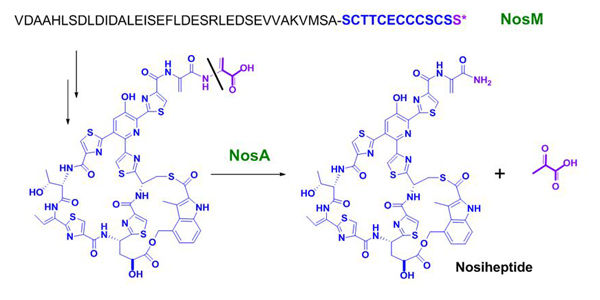
经过进一步的努力,最近该课题组研究人员以通讯的形式报道了硫肽成员诺丝七肽(nosiheptide)生物合成途径中一个新型蛋白NosA的功能(J. Am. Chem. Soc. 2010,132(46), 16324-16326)。NosA作用于一个末端为双脱水丙氨酸的硫肽中间产物(来源于前体肽NosM)以催化酰胺的形成:首先,末端的脱水丙氨酸残基异构形成甲基亚胺,在水分子的亲核进攻下生成水合产物;接着,后者通过C-N键的断裂来完成诺丝七肽合成的最后一步反应,形成末端酰胺的同时释放出丙酮酸。这一机制在含吲哚侧环的硫肽成员生物合成途径中具有普遍性,其底物特征在于前体肽在羧基端带有一个额外延伸的丝氨酸。NosA蛋白功能的发挥有赖于丝氨酸在早期的翻译后修饰过程中脱水形成烯胺的结构,其转化侧链开环底物的能力为运用组合生物合成的技术改变硫肽末端的功能性提供了选择。该研究工作得到国家自然科学基金委、科技部、中国科学院和上海市科委的资助。
附件下载:

