

上海有机所在自噬受体蛋白STBD1介导糖原自噬的分子机制研究方面取得新进展
糖原作为哺乳动物细胞内储存葡萄糖的主要形式,是细胞内最重要的供能物质之一。在哺乳动物细胞中,糖原的分解代谢主要包括两条不同的途径:(1)胞质糖酵解过程;(2)溶酶体依赖的糖原自噬过程(glycophagy)。糖原的分解代谢对于维持血糖平衡、细胞能量供给至关重要,其异常与众多的人类疾病密切相关,例如庞贝氏症(Pompe’s Disease)。庞贝氏症是一种由于溶酶体酸性葡萄糖苷酶功能缺陷导致糖原在溶酶体中异常累积的糖原累积病,其发生进一步强调了糖原自噬过程的重要性。STBD1是哺乳动物细胞内目前唯一已知的参与糖原选择性自噬的自噬受体蛋白,但是目前对于STBD1如何选择性地识别糖原以及如何介导糖原自噬的具体分子机制仍然未知。
近日,潘李锋课题组与俞飚课题组合作,在美国科学院院刊(PNAS)在线发表了题为 “Decoding the molecular mechanism of selective autophagy of glycogen mediated by autophagy receptor STBD1”的研究论文(https://www.pnas.org/doi/10.1073/pnas.2402817121)。该团队首先利用凝胶共迁移、分析型超速离心技术、核磁共振等多种实验方法,详细研究了自噬受体蛋白STBD1与糖原等相关糖类分子之间的相互作用,发现STBD1的CBM20结构域可以直接结合糖原、麦芽糖等糖类分子。随后,利用X射线单晶衍射技术,首次解析了STBD1 CBM20结构域结合麦芽四糖的高分辨复合物结构,并发现STBD1的CBM20结构域具有两个葡聚多糖的结合位点。除了经典的葡聚多糖的结合位点外,STBD1的CBM结构域还含有一个非常特殊的葡聚多糖的结合位点。进一步的结构建模和突变实验证实,STBD1的CBM结构域可以通过这种双位点的作用模式同时结合由α-1,6-葡萄糖苷键连接的分支葡聚糖中的两条不同的线性葡聚糖链,进而选择性地识别糖原。同时,该团队也详细研究了STBD1与六个人源ATG8家族蛋白之间的相互作用,并发现STBD1可以通过其LIR基序选择性地识别六个人源ATG8家族蛋白。该团队进一步解析了STBD1的 LIR基序结合ATG8家族蛋白GABARAPL1的复合物结构,详细阐明了STBD1选择性识别ATG8家族蛋白的分子机制,并通过相关的细胞生物学实验进一步证明STBD1可以在细胞内协同结合糖原和GABARAPL1。后续,基于氨基酸序列的比对分析和质谱鉴定,该团队首次发现STBD1的LIR模序可以作为FIR模序直接结合自噬起始ULK复合物亚基RB1CC1的Claw结构域,并通过多种生化实验和结构建模等方法揭示了STBD1的LIR模序结合RB1CC1的Claw结构域的具体作用模式,进而系统阐明了STBD1招募RB1CC1的分子机制。此外,该团队还通过核磁共振实验证实了RB1CC1和GABARAPL1会竞争性地结合STBD1的LIR模序。
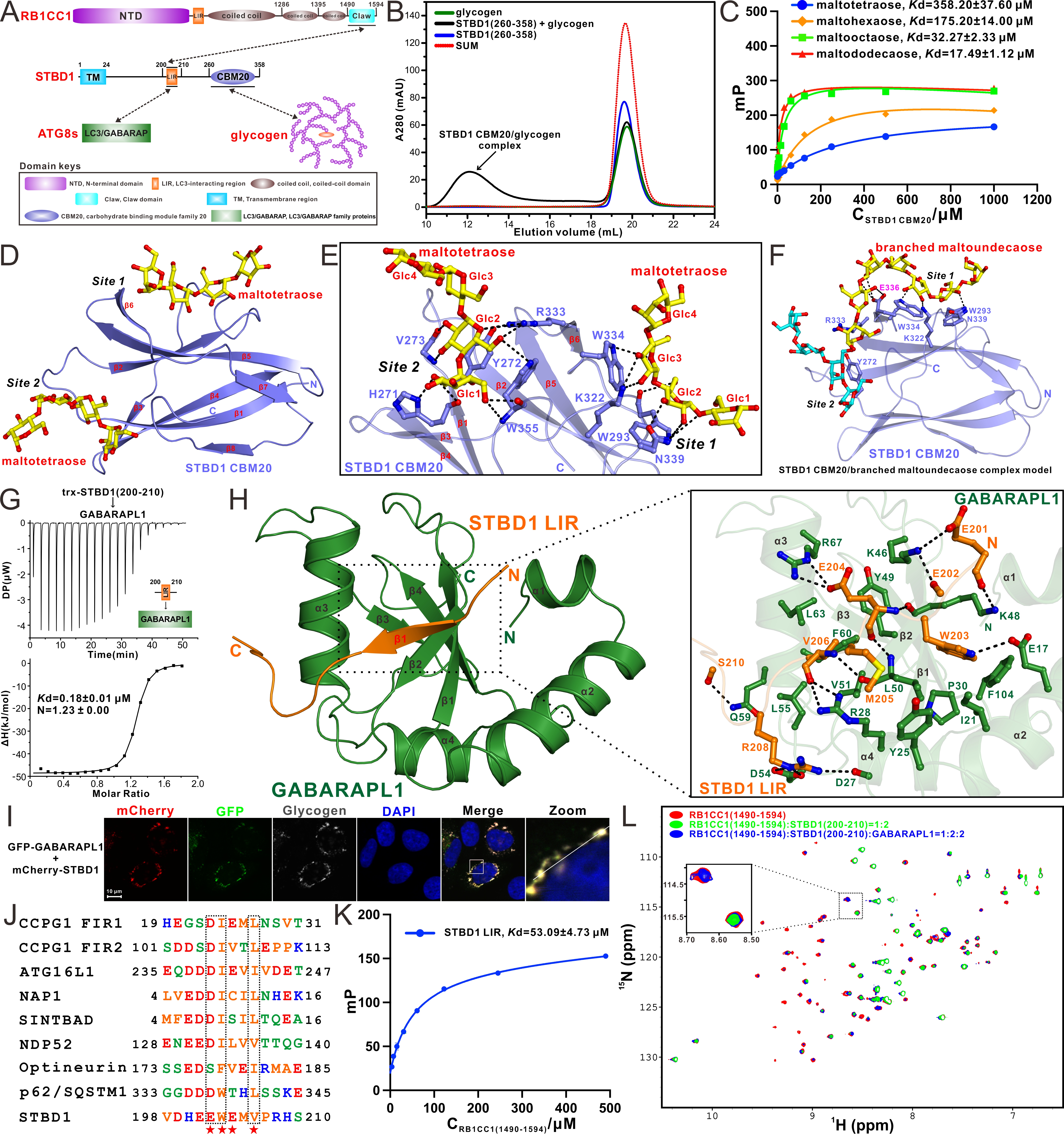
图1. STBD1结合糖类、ATG8家族蛋白和RB1CC1的分子机制
综上所述,该研究工作首次揭示了自噬受体蛋白STBD1通过双位点模式选择性识别糖原的分子机制。同时,首次发现STBD1可通过其LIR 模序直接结合自噬起始关键因子RB1CC1,并详细揭示了STBD1通过LIR模序招募自噬起始ULK复合物和ATG8家族蛋白的分子机制和相互之间的关系。总之,该研究工作从生化和结构角度系统地阐明STBD1了识别糖原以及招募RB1CC1和ATG8家族蛋白的分子机制,扩展了领域内对于自噬受体蛋白STBD1介导糖原自噬过程的分子机制的认识。
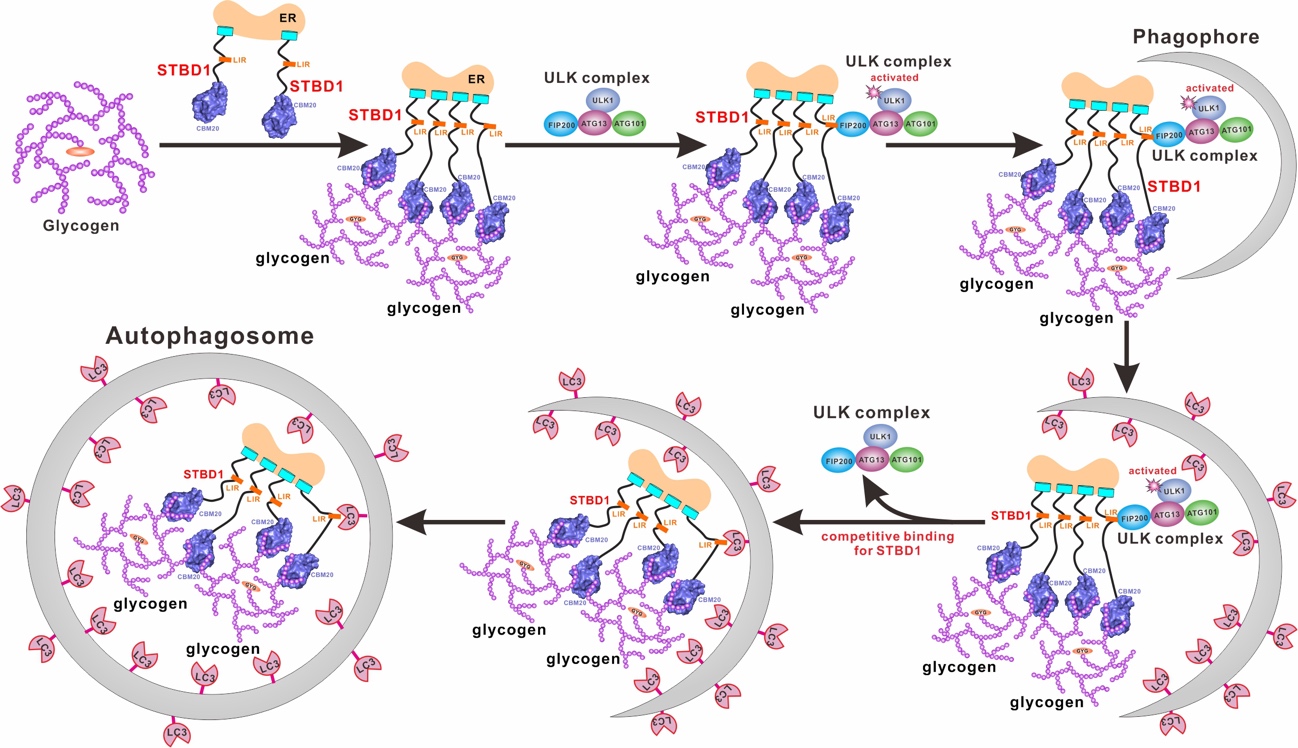
图2. 糖原自噬中STBD1识别糖原并招募ULK复合物、ATG8家族蛋白的模型示意图
中国科学院上海有机化学研究所已毕业的博士生张玉超和上海科技大学物质科学与技术学院的孙一珊同学为本文的共同第一作者。中国科学院上海有机化学研究所的潘李锋研究员和俞飚研究员为本文的共同通讯作者。上述研究工作得到上海蛋白质中心质谱团队和日本德岛大学Otto Baba教授的大力支持,同时获得了国家自然科学基金委、科技部国家重点研发专项项目、中国科学院青年交叉团队项目和生命过程小分子调控全国重点实验室的资助。
附件下载:

