

上海有机所交叉中心团队合作揭示帕金森病中脂质代谢紊乱与α-syn病理聚集的内在关系
帕金森病是继阿尔茨海默病之后的严重威胁人类生命健康的第二大类神经退行性疾病。其主要病理特征是α-突触核蛋白(α-synuclein,α-syn)异常聚集在神经细胞内形成的Lewy小体,导致神经元的退化和死亡。除此之外,与脂质代谢相关的遗传突变也被发现与帕金森病的发病有关。虽然我们已经认识到α-syn与脂质之间的相互作用在其功能和聚集中起着一定的作用,但确切涉及的脂质类型以及脂质代谢问题如何触发α-syn的聚集和神经退行性仍然不清楚。这方面的研究对于理解帕金森病的发病机制以及开发相关治疗策略至关重要。
2024年5月25日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组,朱正江课题组与美国辛辛那提大学医学院癌症生物学系刁佳杰课题组合作在National Science Review杂志在线发表了题为“Lysophosphatidylcholine binds α-synuclein and prevents its pathological aggregation”的研究成果。该工作首次发现并鉴定了一类特异性识别帕金森病关键致病蛋白α-syn的单体形式的脂类分子,即溶血磷脂酰胆碱(lysophosphatidylcholine,LPC),并揭示了LPC在稳定α-syn天然构象及抑制病理聚集方面的关键作用,建立了帕金森病中脂质代谢紊乱与α-syn病理聚集的内在联系,为治疗帕金森病提供了新思路。

在本工作中,研究者们首先通过非靶向脂质代谢组学的方法,在体外、细胞和小鼠脑组织中发现并鉴定了α-syn单体的内源性脂质配体 – 溶血磷脂。进一步研究表明,LPC可以诱导α-syn从相对无结构状态转变为紧凑、稳定的α-helix结构,并抑制α-syn的病理性聚集(图1)。值得注意的是,引入帕金森病家族性突变体A30P会破坏α-syn与LPC的结合,从而促进α-syn的病理性聚集。此外,溶血磷脂在细胞中的减少也会导致α-syn聚集的增加。本工作强调了LPC在保持α-syn的天然构象以抑制异常聚集中的关键作用,建立了脂质代谢功能障碍与帕金森病中α-syn异常聚集之间的潜在联系。
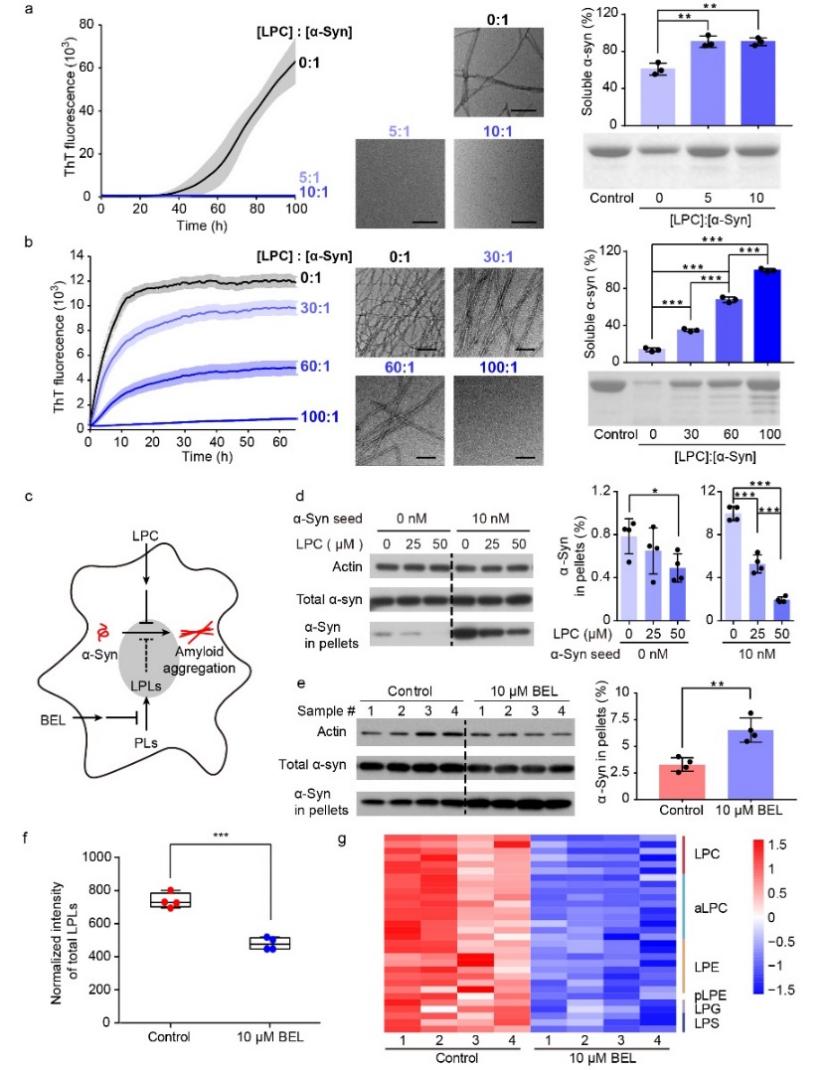
图1. LPC在体外和细胞水平抑制α-syn的病理性聚集
附件下载:

