上海有机所交叉中心团队受邀综述糖基化修饰调控蛋白质聚集和相分离的最新研究进展
蛋白质通过液-液相分离和淀粉样聚集形成具有各种不同生理和病理活性的蛋白质凝聚体。然而,由于蛋白质凝聚体组装的高度动态性,组分异质性和复杂性,现有的技术手段和方法存在显著的限制,因此,迫切需要引入创新的化学分析测量方法以及化学工具,以推动对蛋白质凝聚体的深入研究。最近,中国科学院上海有机化学研究所生物与化学交叉中心的刘聪研究员和西湖大学理学院的张鑫教授被邀请作为客座编辑,为《Current Opinion in Chemical Biology》期刊组织了一期聚焦“蛋白质聚集与相分离的化学生物学研究”的专刊 (https://www.sciencedirect.com/journal/current-opinion-in-chemical-biology/special-issue/10H73GWPZXT)。他们邀请了十余位相关领域的国内外知名学者,从多个角度综述了近年来通过开发不同的化学生物学新方法和工具研究蛋白质凝聚体的最新科研进展。
在这个专刊中,刘聪研究员与北京大学化学与分子工程学院陈兴教授共同发表了一篇题为“Emerging roles of O-glycosylation in regulating protein aggregation, phase separation, and functions”的综述文章。文章从翻译后修饰调控蛋白凝聚过程的角度出发,系统地总结了蛋白质O-糖基化在调控蛋白质病理聚集和动态液-液相分离中的复杂多重作用,并讨论了当前蛋白质糖基化修饰研究手段的局限性和本领域未来研究的潜在发展方向。
蛋白质翻译后修饰在调节蛋白质结构、细胞定位以及生物功能等方面起着关键作用。蛋白质的O-糖基化修饰是翻译后修饰中最多样化且丰富的一种,它广泛参与多种生命过程的调控。近年的研究揭示O-糖基化修饰对蛋白质的病理淀粉样聚集和液-液相分离起到复杂而重要的的调控作用,这些过程的紊乱与神经退行性疾病(Neurodegenerative Disease, ND)和癌症等疾病密切相关。在这篇综述中,作者首先概述了O-糖基化在调节与ND相关的不同淀粉样蛋白质病理性聚集中所采取的四种主要调控机制,它们分别是:1)阻断蛋白质聚集关键节点;2)诱导形成新的聚集结构;3)增强分子伴侣活性防止蛋白聚集;4)调节细胞对病理性聚集的摄取。
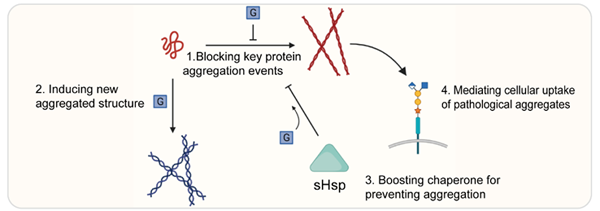
图1. O-糖基化调节蛋白病理聚集的四种主要机制
进一步地,作者介绍了 O-GlcNAc修饰如何调控神经突触中含有低复杂度结构域(low-complexity region, LCR)的蛋白质液-液相分离的最新发现。作者详细阐述了O-GlcNAc修饰在SynGAP/PSD-95 相分离中显性负调控的作用,以及其抑制富含LCR蛋白质相分离发生的分子机制,并进一步提出,O-GlcNAc修饰可能作为一种普适性的调控机制,调控多种蛋白的动态相分离过程。
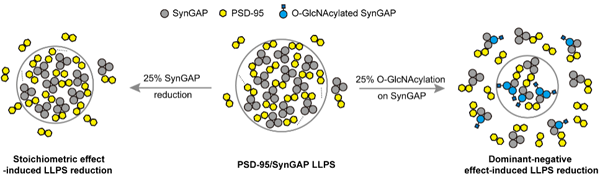
图2. O-GlcNAcylation调控PSD-95/SynGAP 液-液相分离的示意图
最后,作者系统总结了当前研究蛋白O-糖基化调控蛋白凝聚的化学,物理及生物学多学科交叉研究方法和策略, 包括制备位点特异性糖基化修饰蛋白;基于质谱的方法系统地探索不同类型的O-糖基化,以及整合多学科方法来探索O-糖基化调节蛋白功能的分子机制。在总结中,作者还提出了该领域未来研究的挑战,并展望通过靶向调控蛋白质O-糖基化以发展全新的疾病诊断和治疗策略的可能性。
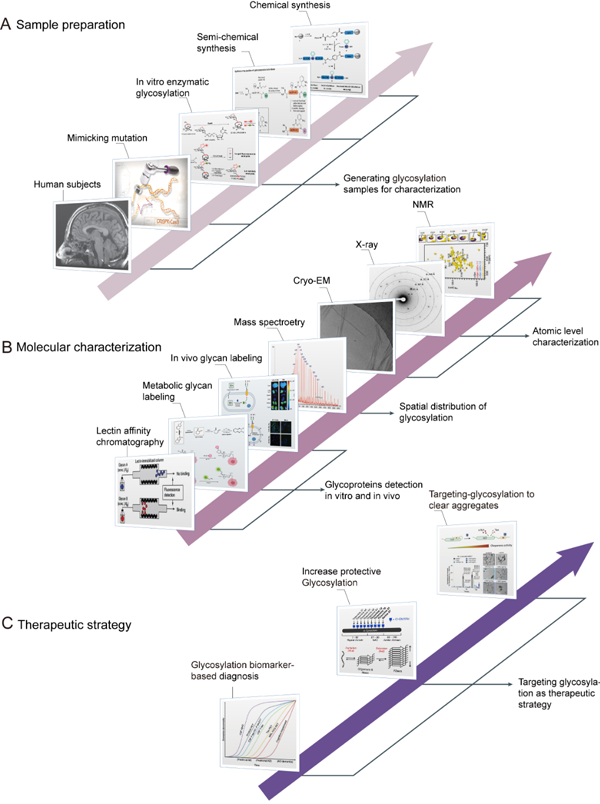
图3. 蛋白凝聚体O-糖基化调控的研究策略及在疾病的诊断与治疗中的潜在应用
该工作得到了来自于国家自然科学基金委,科技部,及上海市科委等项目及基金的资助。
论文链接:
https://www.sciencedirect.com/science/article/abs/pii/S1367593123000522?via%3Dihub
附件下载: