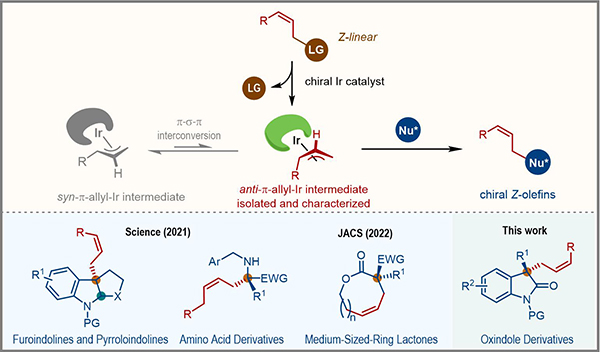
Z-烯烃片段广泛存在于天然产物和药物分子中。但由于大位阻取代基位于双键同侧,Z-烯烃相对于E-烯烃热力学不稳定,因此其高选择性合成极具挑战性。过渡金属催化的不对称烯丙基取代反应通过利用亲核试剂捕获π-烯丙基金属配合物中间体,可以高效构建含有烯烃片段的手性化合物。但是该类反应一般经历热力学稳定的syn-π-烯丙基金属配合物,得到末端烯烃或者E-烯烃产物。
2021年,中国科学院上海有机化学研究所游书力研究团队利用“活泼前手性亲核试剂捕获亚稳态anti-π-烯丙基金属配合物”的策略,实现了铱催化Z式保留不对称烯丙基取代反应,高效地构建了一系列含有Z-烯烃片段的复杂手性分子(图1,Science 2021, 371, 380; J. Am. Chem. Soc. 2022, 144, 4770.)。在这类反应中,anti-π-烯丙基铱配合物一般被推测为关键的催化活性中间体,对其分离、表征及性质研究具有重要的意义。但该中间体热力学不稳定,容易通过π-σ-π异构化过程转化为热力学稳定的syn-π-烯丙基铱配合物,导致其分离表征十分具有挑战性。
图1 铱催化Z式保留不对称烯丙基取代反应
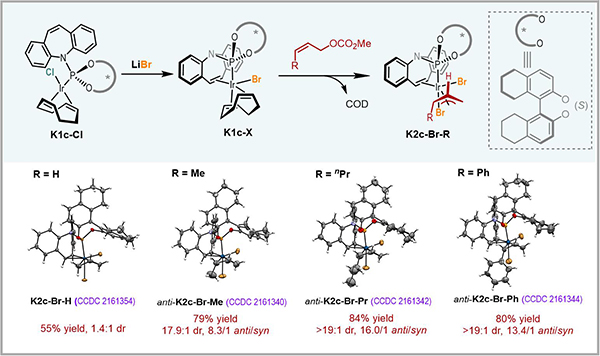
在前期工作中,研究人员通过核磁共振磷谱(31P NMR)和高分辨质谱(HRMS)对一类手性磷/烯烃配体衍生的anti-π-烯丙基铱配合物(三氟甲磺酸根为抗衡阴离子)的生成以及异构化过程进行了表征,但未能实现该配合物的分离鉴定。最近研究人员通过向体系中引入强配位的卤离子,提升anti-π-烯丙基铱配合物的稳定性,成功实现了一系列anti-π-烯丙基铱配合物的合成,并通过单晶X射线衍射确证了其结构(图2)。同时通过核磁共振磷谱表征了anti-π-烯丙基铱配合物向热力学稳定的syn-π-烯丙基铱配合物的异构化过程,并且证实异构化所需的时间长于亲核进攻。这是实现Z式保留的不对称烯丙基取代反应的关键因素。
图2 anti-π-烯丙基铱配合物的合成及表征
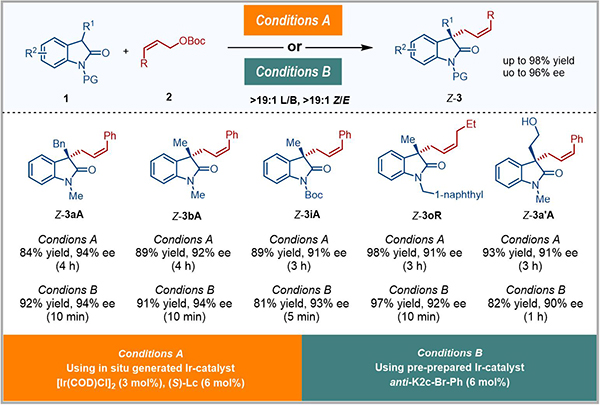
该类anti-π-烯丙基铱配合物可以高效催化一系列吲哚-2-酮衍生的前手性亲核试剂与Z-烯丙基碳酸酯的Z式保留的不对称烯丙基取代反应(图3)。研究发现使用预先制备的铱配合物能取得与原位生成的铱催化剂相当的收率(81~97%)和选择性(L/B > 19/1, Z/E >19/1, 90-94% ee),并将反应时间从2小时到1天,缩短为5分钟到1小时。
图3 铱催化吲哚-2-酮衍生物参与的Z式保留不对称烯丙基取代反应
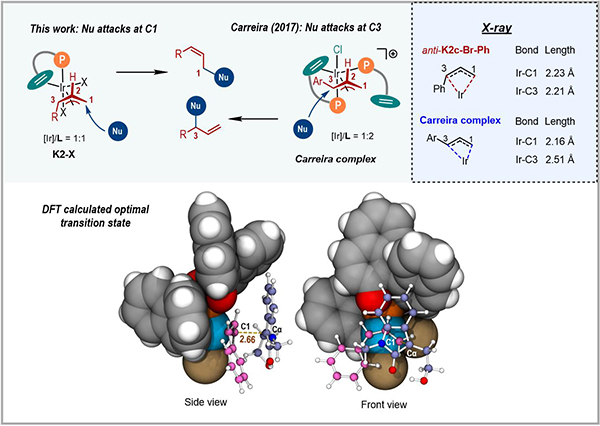
研究人员通过分析anti-π-烯丙基铱配合物([Ir]/L = 1:1)的几何和电子结构揭示了反应区域选择性的成因(图4)。由于磷配体并不处于烯丙基任何一端(C1和C3)的反位,使得C1–Ir键和C3–Ir键的键长以及Mayer键级基本相同,因此亲核试剂优先进攻位阻较小的C1位。这与文献报道的由同类手性配体衍生的铱配合物([Ir]/L = 1:2)明显不同。研究人员进一步使用DFT计算考察了吲哚-2-酮负离子进攻anti-π-烯丙基铱配合物的过渡态,提出了该反应的手性控制模型。
图4 铱催化Z式保留不对称烯丙基取代反应的区域/对映选择性模型
综上所述,该项工作报道了Z式保留不对称烯丙基取代反应中关键的anti-π-烯丙基铱配合物中间体的合成、分离与表征,深入研究了其形成、异构化和与亲核试剂反应的机制。在此基础上发展了一类新型的Z式保留不对称烯丙基取代反应,提出了反应区域选择性成因和手性诱导模型。研究论文以全文形式在线发表于Nature Catalysis(DOI: 10.1038/s41929-022-00879-z)。这项成果对于进一步发展Z式保留不对称烯丙基取代反应,合成手性Z-烯烃奠定了坚实的基础。
上述研究工作得到了科技部、国家自然科学基金委、中国科学院、上海市科委和腾讯基金会的资助。