上海有机所交叉中心发现SENP1通过抑制RIPK1介导的凋亡和炎症抑制脂肪性肝炎
发布时间:2022-11-30交叉中心| 【 大 中 小 】【打印】 【关闭】
非酒精性脂肪肝病(NAFLD)是一种普遍发生的肝脏类疾病,其可进一步发展成非酒精性脂肪肝炎(NASH)。NASH的主要病理特征包括肝脂肪变性、肝炎、肝纤维化等。肝细胞死亡与炎症是造成NASH发展成终点肝病,如肝硬化、肝癌等的最重要的两个因素。但在NASH中,肝细胞死亡以及炎症发生的机制目前并不明确。RIPK1是一种丝氨酸/苏氨酸蛋白激酶,在肿瘤坏死因子(TNF)通路中,RIPK1是调节细胞存活、死亡以及炎症的核心蛋白。RIPK1的激活被发现与人类多种炎症性疾病和退行性疾病密切相关。在NASH小鼠模型和 NASH人类患者中均发现RIPK1的激活,并且抑制 RIPK1激酶活性可以降低小鼠NASH模型中的肝脏炎症和肝损伤。这表明RIPK1激活在NASH肝细胞死亡和炎症中发挥了重要作用,但其激活的具体机制仍不清楚。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超课题组在Nature Communications 杂志上在线发表了题为“SENP1 prevents steatohepatitis by suppressing RIPK1-driven apoptosis and inflammation”的论文,对这一问题进行了探索。
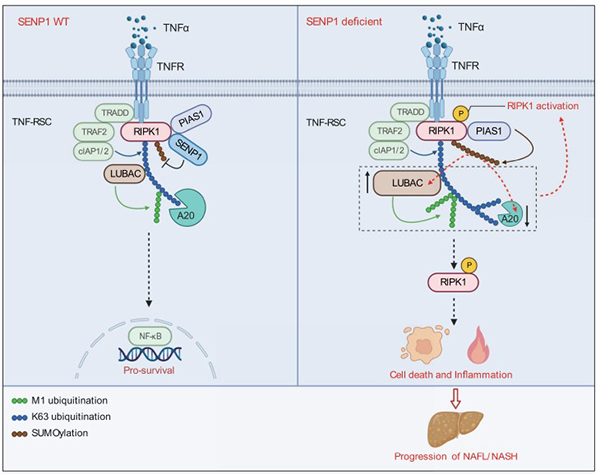
在这项研究中,作者通过小干扰RNA筛选鉴定出SENP1(一种 SUMO 特异性蛋白酶)为 RIPK1 的关键内源性抑制蛋白。他们发现SENP1的表达与NASH患者的病理程度呈负相关。在小鼠当中,肝细胞特异性SENP1基因敲除以RIPK1 激酶依赖的方式产生自发性的NASH相关表型。作者证明 SENP1 缺陷通过在TNF刺激后促进RIPK1的激活,使细胞对RIPK1激酶依赖的细胞凋亡更加敏感。机制上,SENP1 缺失会促进PIAS1介导的RIPK1的SUMOylation类泛素化修饰,RIPK1的SUMOylation修饰进而重新编排TNF受体超级复合物(TNF-RSC),通过下调去K63形式泛素修饰的酶A20,以及上调介导M1形式泛素修饰的LUBAC复合物来重新编程RIPK1的泛素化模式,并最终激活RIPK1,导致细胞死亡及炎症的发生。
图 SENP1通过在TNF-RSC中调节RIPK1的去SUMOylation修饰控制RIPK1的激活以及NASH的进展
以上研究结果表明SENP1对RIPK1的去SUMOylation修饰提供了一个全新的细胞死亡检查点,通过监控和调节RIPK1的激活,进而影响了细胞死亡和炎症以及最终NASH的发生发展。
上述工作主要由许代超课题组博士生严灵杰等人完成。项目受到了新华医院肝移植中心顾劲杨教授等的大力支持。这项研究受到了国家重点研发计划,国家自然科学基金委,中科院先导专项和上海市科委的资助。