近日,中科院上海有机化学研究所生物与化学交叉中心张胜男副研究员(刘聪课题组)与美国迈阿密大学的Grace Zhai以及上海交通大学Bio-X研究院李丹课题组合作,在eLife杂志在线发表了题为“Specific binding of Hsp27 and phosphorylated Tau mitigates abnormal Tau aggregation-induced pathology”的研究论文。该研究发现分子伴侣Hsp27能够特异性识别并有效抑制病理性的磷酸化微管相关蛋白Tau(phosphorylated Tau, pTau)的淀粉样聚集,并通过整合多种生物物理学方法阐明Hsp27特异性识pTau蛋白的结构基础。进一步,研究人员发现Hsp27可以通过有效抑制pTau病理性聚集来显著延缓pTau在阿尔兹海默病(Alzheimer’s disease, AD)动物模型中产生的病理毒性。本工作为潜在靶向分子伴侣的药物研发提供了新思路。
AD作为最常见的神经退行性疾病,目前全球确诊患者已超过5000万,至今尚无特效药物,其严重影响人类生命健康(尤其是65岁以上老年人)。β淀粉样蛋白沉积形成的细胞外斑块和过度磷酸化的 Tau蛋白在细胞内形成的神经纤维缠结是AD的典型病理学特征。目前,针对β淀粉样蛋白为靶点的抗AD药物研发几乎都以失败而告终,人们把更多的研究目光转移到了Tau蛋白上。Tau蛋白是一类微管相关蛋白,主要位于神经元轴突内,维持微管的稳定性,在轴突生长中起到重要作用。过度磷酸化会使得Tau蛋白从微管解离,并聚集形成病理毒性的淀粉样纤维,这个过程与AD的发生、发展密切相关。分子伴侣蛋白对于维持细胞内蛋白质稳态具有十分重要的作用,多种分子伴侣在不同的AD模型中呈现出不同程度的神经保护作用,分子伴侣目前也被认为是AD药物研发的潜在靶点之一。因此,研究具有病理毒性的pTau与分子伴侣之间的相互作用机制对于AD药物研发具有重要意义。
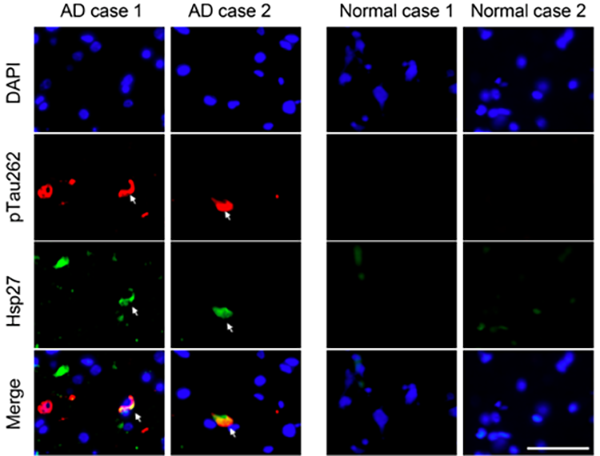
图1 Hsp27在AD病人大脑中与pTau聚集体部分共定位
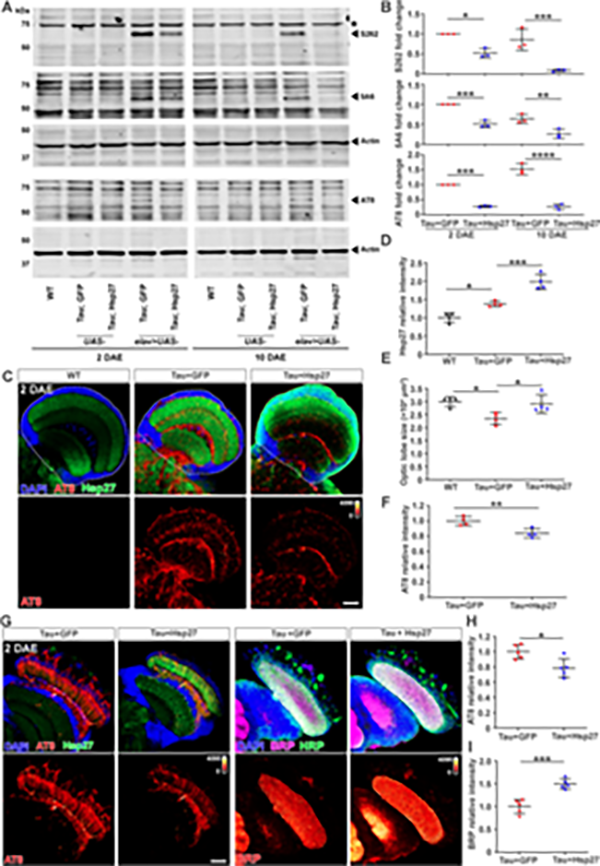
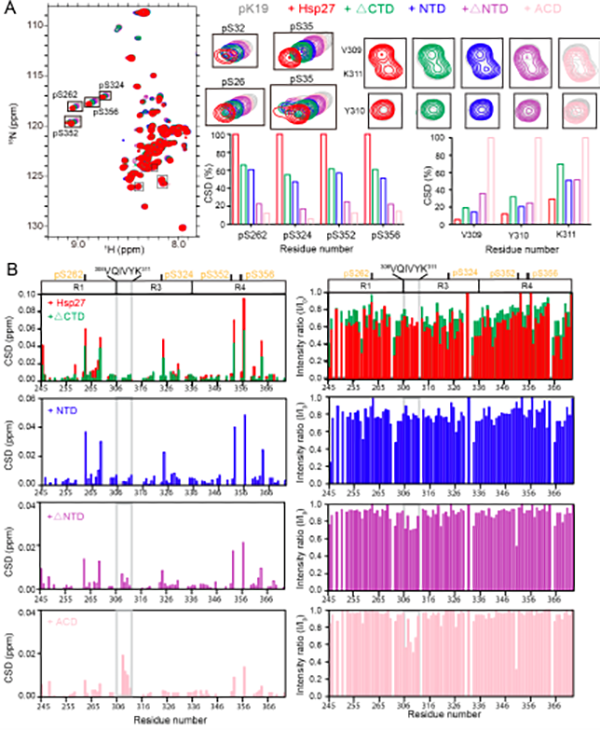
在本项工作中,研究者首先在AD病人大脑的额叶皮层中发现分子伴侣Hsp27的表达量被显著上调,并与pTau聚集体部分共定位(图1)。在 AD果蝇模型中,Hsp27过表达可以显著地降低病理性 pTau的含量,抑制pTau淀粉样聚集,并重塑果蝇大脑神经毡的尺寸(图2)。因此,Hsp27在AD果蝇模型中呈现显著的神经保护作用,其可以通过降低pTau病理毒性的淀粉样聚集来延缓病理性突触退变。进一步的体外研究表明,Hsp27能够特异性识别pTau蛋白并抑制其淀粉样聚集。研究者利用核磁共振和质谱-交联等技术探究了Hsp27特异性识别pTau的分子机制(图3)。Hsp27的不同结构域在结合并抑制pTau淀粉样聚集中起着不同的作用,Hsp27主要利用其N端结构域识别pTau蛋白的多个病理性磷酸化位点,进而抑制pTau的淀粉样聚集。同时,Hsp27利用其核心结构域通过结合pTau的聚集核心区域(306VQIVYK311)来抑制其病理性聚集。
图2 Hsp27在AD果蝇模型中降低pTau含量及病理性聚集,从而有效延缓pTau诱发的突触退变
综上,本工作发现分子伴侣Hsp27在体内和体外通过特异性识别具有病理毒性的pTau,抑制其淀粉样聚集,并显著延缓其引起的神经病理毒性,揭示了Hsp27与pTau相互作用的分子机制。本工作对于揭示分子伴侣在AD中如何发挥神经保护作用提供了新的理论依据,为靶向分子伴侣的AD预防和药物研发提供了新的思路。
图3 Hsp27不同结构域和截断型pTau的相互作用表征
中科院上海有机所生物与化学交叉研究中心刘聪课题组张胜男副研究员,Grace Zhai课题组博士研究生朱一,李丹课题组博士研究生卢金霞和刘聪课题组博士研究生刘振颖为共同第一作者。美国迈阿密大学的Grace Zhai教授与上海交通大学李丹教授为本工作共同通讯作者。交叉中心的贺焯皓及张耀阳课题组均对本课题做出了重要的实验方面的支持。