

上海有机所揭示首例催化Alder-ene反应的酶及其周环选择性分子机制
中国科学院上海有机化学研究所生命有机化学国家重点实验室周佳海课题组和美国加州大学洛杉矶分校(UCLA)唐奕课题组与Kendall N. Houk课题组合作,首次表征了自然界中催化Alder-ene反应的酶及其催化氧杂Diels-Alder(DA)反应的同源蛋白,解析了这两类酶及其复合物的高分辨率晶体结构,基于结构信息和计算指导通过定点突变实现了周环选择性的逆转,阐明了两类酶如何利用几乎相同的活性位点实现周环选择性的精准控制。该工作发表在《自然》(Nature 2020, 586, 64.)上,唐奕课题组的Masao Ohashi博士、博士研究生 Cooper S. Jamieson和周佳海课题组的博士研究生蔡毓娟并列论文第一作者。
周环反应是指具有环状过渡态的协同反应,这类反应在天然产物合成中常常被应用于高效构建多个碳碳键,而且具有较好的立体选择性和区位选择性。自2011年美国德克萨斯大学Austin分校的刘鸿文课题组首次鉴定出能够催化DA反应的周环酶SpnF后(Nature 2011, 473, 109.),科学家先后从多种天然产物的生物合成途径中鉴定出了不同的新型周环反应酶(Nat. Prod. Rep. 2019, 36, 698.)。2019年,周佳海课题组与唐奕课题组合作,系统地阐释了多功能周环酶LepI立体选择性脱水与催化杂DA反应、逆Claisen重排反应的分子机制(Nat. Chem. 2019, 11, 812.)。
唐奕课题组以LepI为基础,从真菌天然产物生物合成途径中鉴定出6个具有很高序列相似度的O-甲基转移酶蛋白PdxI、AdxI、ModxI、EpiI、UpiI及HpiI。通过体外酶学发现并验证PdxI、AdxI、ModxI催化Alder-ene反应,而EpiI、UpiI、HpiI催化氧杂DA反应。周佳海课题组解析了Alder-ene反应酶PdxI以及氧杂DA反应酶HpiI的apo晶体结构,同时也得到了这两个酶与底物类似物以及产物的共晶结构。在此基础上,Houk课题组对Alder-ene反应酶PdxI催化体系进行了DFT理论计算、分子对接以及动力学模拟,揭示了PdxI/AdxI/ModxI、EpiI/UpiI/HpiI这两组同源性的周环酶因为进化上的细微分歧导致了不同周环选择性的分子机制。该工作不仅加深了对周环反应酶催化机制的理解,也为探索Alder-ene反应和杂DA反应的新型生物催化剂提供了新的启示。
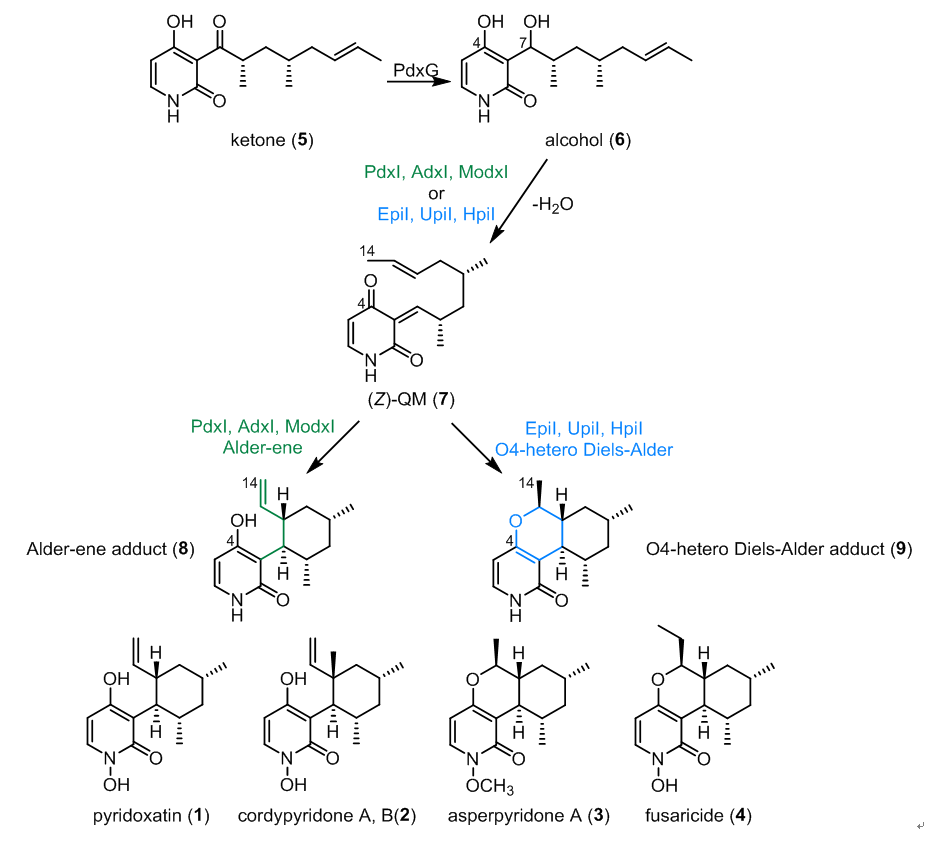
图1 吡啶酮类天然产物pyridoxatin及其类似物的部分生物合成途径
该工作得到了自然科学基金委重大研究计划重点项目和上海市优秀学术带头人项目、上海市国际合作项目的资助,晶体衍射数据是在上海光源BL17U1和国家蛋白质设施BL18U1 、BL19U1处收集。
附件下载:

