

上海有机所在自噬SNARE蛋白Syntaxin17介导自噬体-溶酶体融合的分子机制方面取得新进展
中国科学院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究团队在美国科学院院刊(PNAS)在线发表了题为“Decoding three distinct states of the Syntaxin17 SNARE motif in mediating autophagosome-lysosome fusion”的研究论文(https://doi.org/10.1073/pnas.2006997117)。该项工作对自噬SNARE蛋白Syntaxin17及其与ATG8家族蛋白、SNAP29和VAMP8的相互作用做了详尽的生化和结构表征,揭示了Syntaxin17在介导自噬体和溶酶体融合过程中三种不同的状态(图1),为进一步理解自噬体和溶酶体的融合过程提供了坚实的结构基础。潘李锋课题组的博士生李颖为本文的第一作者。
细胞自噬是真核细胞内一种高度保守的溶酶体依赖的分解代谢过程。该过程的功能紊乱与多种疾病相关,包括癌症、糖尿病和神经退行性疾病等。在自噬过程后期,具有双层膜结构的自噬体与单层膜结构溶酶体融合形成自噬溶酶体,溶酶体内水解酶将自噬体内膜及其包裹的物质降解成小分子以供细胞循环利用。目前为止,许多蛋白被认为参与到自噬体-溶酶体融合这一过程,包括SNARE蛋白、ATG8家族蛋白、系绳因子HOPS复合物以及ATG14蛋白等。其中,Syntaxin17蛋白作为一个关键的自噬相关的SNARE蛋白,可以结合ATG8家族蛋白、以及另两个SNARE蛋白SNAP29和VAMP8蛋白促进自噬体和溶酶体的融合过程,但是这些蛋白相互协作实现融合的具体分子机制尚不清楚。
为了探究这一重要问题,其团队成员综合运用核磁共振技术、等温滴定量热技术、快速蛋白液相色谱、圆二色谱和分析型超速离心等多种生化表征手段,首次发现Syntaxin17的SNARE模序可以结合自身的Habc结构域,单独存在的Syntaxin17处于一种自抑制的“闭合”状态。同时,该团队还首次揭示了Syntaxin17的SNARE区域中只含有一个LIR模序,其可以选择性地结合ATG8家族蛋白中的GABARAP亚家族成员,并且成功解析了Syntaxin17 LIR/GABARAP复合物的晶体结构。解析的复合物结构不仅揭示了Syntaxin17结合GABARAP的分子机制,而且进一步强调了LIR模序中核心序列后的羧基端扩展区域对选择性结合ATG8家族蛋白的重要性。此外,他们也对介导自噬体-溶酶体融合的Syntaxin17/SNAP29/VAMP8 SNARE复合物做了详细的生化表征,并解析了其晶体结构。
上述研究工作得到国家自然科学基金委、科技部、中科院以及生命有机化学国家重点实验室的大力支持。
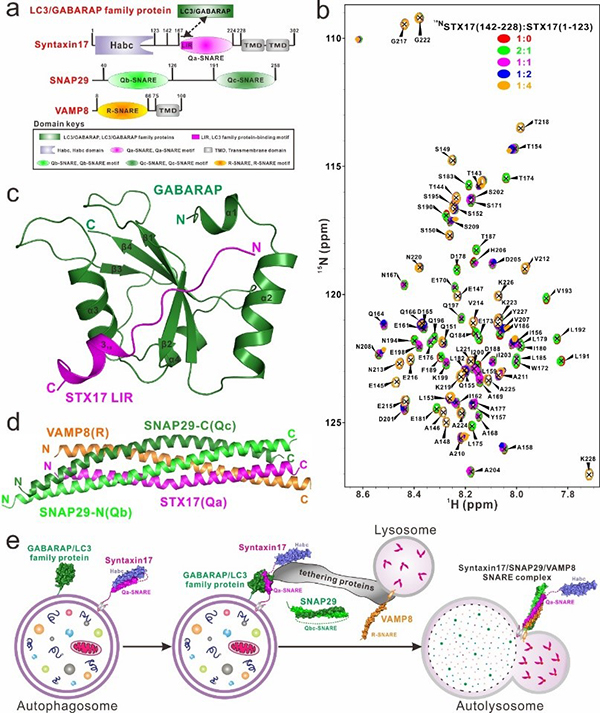
图1. Syntaxin17介导自噬体-溶酶体融合的分子机制
附件下载:

