

上海有机所在反应时长依赖的对映发散性合成方面取得进展
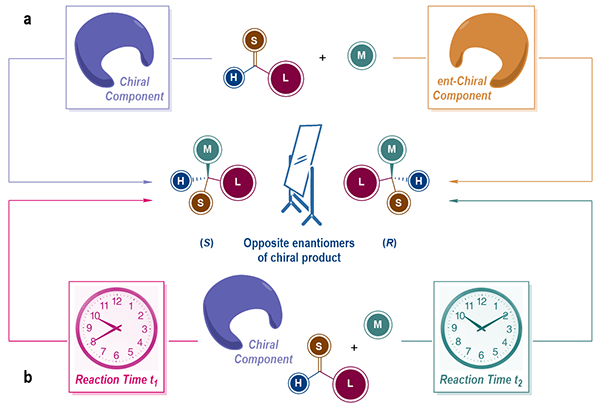
制备手性分子的一对对映异构体是不对称合成的基本任务,其对于药物化学和材料科学具有重要意义。在一般的不对称合成反应中可以通过改变手性源(如手性底物、辅基、试剂、催化剂/配体等)的绝对构型来获取产物的不同对映异构体(图1a)。然而自然界中一些手性源分子仅以单一对映异构体的形式存在,因此难以通过这类手性源分子主导调控的不对称合成反应制备不同绝对构型的目标产物。
另一方面,反应时长也是可以用来调控不对称合成反应产出的重要宏观变量。动力学拆分反应就是利用了外消旋底物分子中的一对对映异构体与手性催化剂之间反应速率的差别,通过精准控制反应时长实现目标产物和底物分子单一对映异构体的富集。但是在一般的动力学拆分反应中产物分子的绝对构型仍然由手性催化剂的绝对构型决定。想要获得产物分子的不同对映异构体仍需使用不同绝对构型的手性催化剂。
最近,中国科学院上海有机化学研究所金属有机化学国家重点实验室游书力研究员团队在研究铱催化的不对称烯丙基去芳构化反应时发现了一种独特的“反应时长依赖的对映发散性合成”现象:在不改变反应体系中手性源绝对构型的条件下,仅通过调节反应时长即可高对映选择性地分别获得目标产物分子的一对对映异构体(Nature Chemistry, 2020, DOI: 10.1038/s41557-020-0489-1)(图1b)。
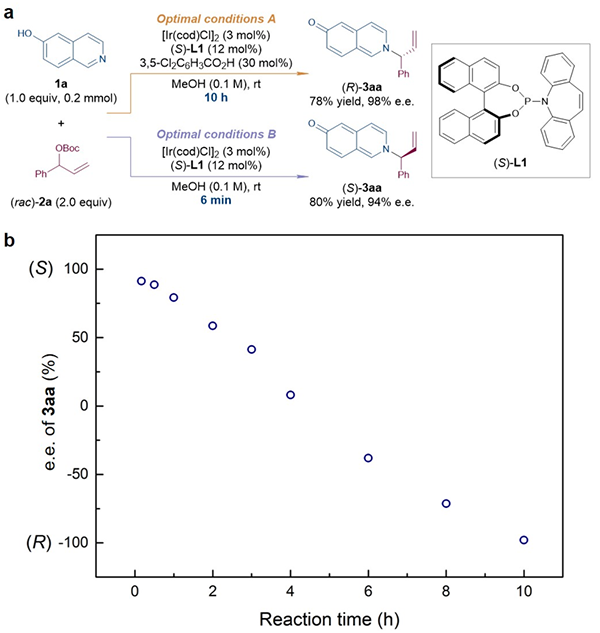
研究人员发现6-羟基异喹啉1a与外消旋烯丙基碳酸酯(rac)-2a在手性亚磷酰胺配体(S)-L1衍生的铱络合物催化下可以在甲醇中发生不对称烯丙基取代反应,生成手性烯丙基胺衍生物3aa。若控制反应时长为10小时则可以以98% ee获得(R)构型目标产物;若将反应时长缩短至6分钟则可以以94% ee获得(S)构型目标产物(图2a)。对反应体系中烯丙基胺3aa的ee值的实时监测清楚地展现出随着反应时长的延长,目标产物的绝对构型发生反转,并且可以在6分钟和10小时高对映选择性地分别获得(S)和(R)构型的目标产物(图2b)。也就是说,该类反应可在不改变手性催化剂绝对构型的情况下,仅通过调节反应时长,即可高对映选择性地制备在有机合成中具有重要应用价值的手性烯丙基胺类分子的不同对映异构体。适用于该类反应的亲核试剂包括一系列6-羟基异喹啉、8-羟基异喹啉和多种芳胺衍生物。
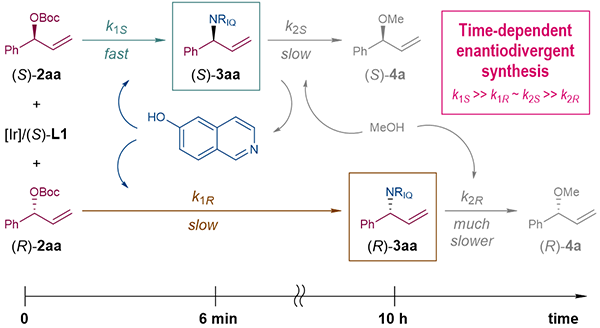
深入的机理研究表明在该反应条件下存在手性铱催化剂对烯丙基碳酸酯和烯丙基胺的两种动力学拆分作用(图3)。首先在(S)-L1衍生的铱催化剂存在的条件下,(S)构型烯丙基碳酸酯活性较高,可以迅速与6-羟基异喹啉反应生成(S)构型烯丙基胺(反应速率常数为k1S)。然而该产物在反应条件下并不稳定,可以在同一铱催化剂作用下与溶剂甲醇反应生成相应的烯丙基甲醚,同时释放出6-羟基异喹啉(反应速率常数为k2S)。另一方面,活性较低的(R)构型烯丙基碳酸酯逐步与6-羟基异喹啉反应,缓慢积累(R)构型烯丙基胺(反应速率常数为k1R)。该产物在反应条件下非常稳定,不易与甲醇发生醚化反应(反应速率常数为k2R)。当两个动力学拆分体系的反应速率彼此匹配时(k1S >> k1R ~ k2S >> k2R),即可在不同的反应时长观察到绝对构型相反的烯丙基胺对映异构体的富集。
“反应时长依赖的对映发散性合成”是不对称合成中的新反应现象,其发现和反应机理研究不仅丰富了不对称催化反应的内涵,更为手性分子不同对映体的高效制备提供了新的途径。(文章链接:https://www.nature.com/articles/s41557-020-0489-1)。
上述研究工作得到了科技部、国家自然科学基金委、中国科学院、上海市科委和腾讯基金会的资助。
附件下载:

