

上海有机所林可酰胺类抗生素的生物合成研究再获重要突破
继2015年在Nature上报道了两个小分子硫醇参与的林可霉素生物合成机制后,近期,中科院上海有机化学有机所刘文团队通过进一步的研究阐明了林可酰胺类抗生素的后期关键生物合成途径(J. Am. Chem. Soc., 2016,138, 6348-6351)。
林可酰胺类抗生素(lincosamides)是一类临床上重要的抗生素家族,其代表成员林可霉素(lincomycin)长期被用于治疗革兰氏阳性菌引起的感染。在前期的研究中,刘文团队发现林可霉素的生物合成是在两个小分子硫醇(ergothionein, EGT和mycothiol, MSH)的相互配合且精确有序地指导下完成的(Nature, 2015, 518, 115-119)。这一发现不仅代表了EGT参与生化反应的首个范例,而且提供了一种MSH依赖的硫元素引入的新模式(图1)。更重要的是,这一发现代表了洞悉小分子硫醇在生物体系中的内在功能方面所迈出的重要一步。因此,团队受邀于BioEssays杂志对小分子硫醇的功能进行相关综述和展望(Bioessays,2015, 37, 1262-7)。
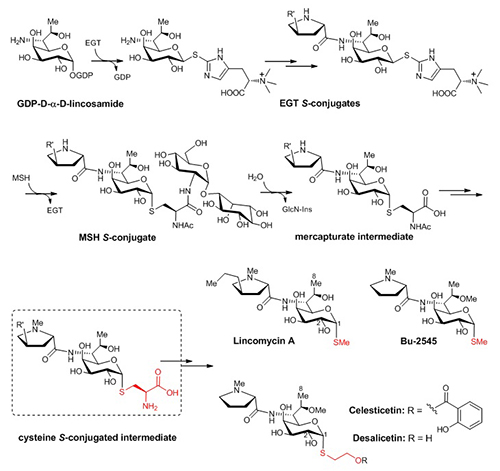
图1 小分子硫醇参与的林可酰胺类抗生素生物合成途径
天然来源的林可酰胺类抗生素都是由链霉菌产生,主要包括林可霉素(lincomycin)及其结构类似物天青菌素(celesticetin)。但明显不同的是,最终产物的结构中却存在两种不同的硫修饰基团:在林可霉素中是硫甲基,而在天青菌素中是巯基乙醇的两碳单元(图1)。围绕林可酰胺类抗生素中不同硫修饰的形成机制,刘文团队展开了一系列详尽的体内(in vivo)及体外(in vitro)研究。他们发现:在天青菌素的后期生物合成途径中,MSH来源的半胱氨酸结合物,在CcbF蛋白催化下发生特殊的氧化性脱羧反应生成醛式产物,随后在O-甲基化酶Ccb4及还原酶Ccb5作用下生成最终的含两碳单元的desalicetin;而在林可霉素的后期生物合成途径中,也存在类似的半胱氨酸结合物中间体,其在LmbF蛋白催化下发生β裂解反应生成自由的巯基中间产物,随后在LmbG催化下发生硫甲基化生成终产物林可霉素。这一对序列上高度同源但活性截然不同的PLP酶(CcbF和LmbF)决定了不同的半胱氨酸基团剪切方式,再在不同的后修饰酶的协同作用下,最终生成了林可霉素和天青菌素中不同的硫修饰结构(图2)。在完全阐明两种后期生物合成途径后,他们采用体外组合生物合成的方式,对这两种途径中共同的半胱氨酸中间体分别进行不同的硫处理及后修饰,成功得到了一系列杂合的林可酰胺类抗生素(包括天然来源的 Bu-2545)。
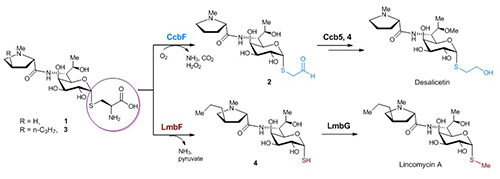
图2 林可酰胺类抗生素的不同硫修饰形成机制
以上研究发现不仅阐明了林可酰胺类抗生素结构差异的产生机制,也证实了PLP酶学反应的多样性,及其在合成生物学中的应用。PLP依赖的酶是生物体内广泛存在的一大类蛋白,参与多种重要的涉及氨基(酸)底物的代谢反应,如转氨、脱羧、异构化、消除、Claisen缩合等。而在林可酰胺类抗生素生物合成体系中,CcbF和LmbF这两种PLP依赖的酶虽然同一性高达40%(很可能源于共同的进化祖先),催化的底物结构也类似,但是催化的反应类型却截然不同。后者催化的是较常见的β消除反应,而前者却是一种罕见的氧气依赖的酶,催化特殊的脱羧偶联的氧化性脱氨反应。目前,我们熟知的PLP酶活性的多样性都是来源于PLP稳定碳负离子的能力,而只有极少数PLP依赖的酶能活化氧气发生氧化性反应。根据相关生化实验结果及目前已知的氧气活化机制,CcbF催化的反应很可能经历单电子转移生成过氧自由基负离子的过程。PLP蛋白的酶学活性及其催化机制的阐明必将使我们发现更多新颖的PLP相关的生化反应及生理功能。
上述成果主要由刘文课题组的王敏博士、赵群飞副研究员等完成,获得了国家自然科学基金委、科技部和中科院等相关项目的资助。
附件下载:

