

上海有机所在硫肽类抗生素抗胞内菌感染的作用机制研究方面取得进展
感染性疾病是目前全球范围内第二大威胁人类健康的致死疾病,由于抗生素滥用等原因,临床耐药菌的不断产生使得这一现状更为严峻,尤其是由多重耐药结核杆菌等胞内寄生菌感染引起的疾病,临床治疗更加困难。目前新型抗生素的研发速度远慢于临床中耐药菌的产生速度,每当推出一种能够临床安全应用的抗生素,很快就能检测到对其耐药的病原菌,如此往复下去很可能造成最终对感染性疾病“无药可用”的境地。合成化学家和药物化学家均从自己的研究视角出发对此做出努力,其中“老药新用”不失为一个简洁高效的策略。中国科学院上海有机化学研究所生命有机化学国家重点实验室刘文研究员课题组与复旦大学上海医学院医学分子病毒学重点实验室高谦教授课题组合作,阐明了硫肽类抗生素——硫链丝菌素有效杀灭胞内寄生菌的作用机制。相关成果已于7月23日在线发表于Cell旗下子刊Chemistry & Biology杂志上(Chem. Biol., 2015, DOI: http://dx.doi.org/10.1016/j.chembiol.2015.06.019)。
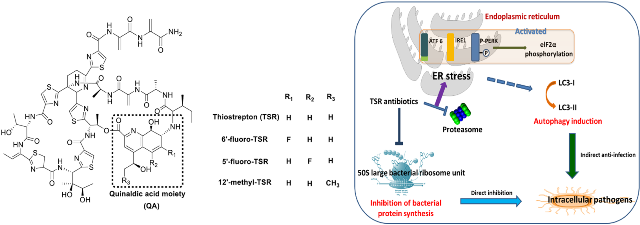
硫肽类抗生素是一类古老的生物活性肽类抗生素,其家族中的诺丝七肽和硫链丝菌素(Thiostrepton, TSR)已被广泛应使用在动物饲料添加剂中,用于清除动物肠道寄生菌;其家族中GE2270A的衍生物LFF571正处于临床二期实验中,用以治疗艰难梭状杆菌引发的感染性疾病。但是由于溶解度较差、生物利用度较低等原因,大多数硫肽类抗生素并没有引起临床科研工作者的足够重视。刘文课题组长期以来致力于硫肽类抗生素的生物合成和结构改造研究,他们通过对于硫链丝菌素生物合成逻辑的分析,从合成化学的角度优化路线,制备了TSR生物合成前体——喹萘啶酸的衍生物文库(Tetrahedron, 2014, 70, 7686-7690.),并基于计算机辅助药物设计,从合成生物学角度出发选择性地使用这些构筑模块对于TSR产生菌的突变株进行化学喂养,由此获得了理化性质和生物活性大为改善的硫链丝菌素衍生物,通过体外活性测试,他们发现这些衍生物溶解度有所提高且对于多种临床常见耐药菌均有极好的杀灭作用,相关研究成果以封面文章的形式发表于英国皇家化学会《有机化学前沿》杂志(Org. Chem. Front., 2015, 2, 106–109.)。
而在本研究中,刘文课题组与高谦课题组展开合作,测试了上述TSR衍生物的抗胞内寄生菌活性,他们选取海分枝杆菌(一种研究结核杆菌常用的模式菌)感染的斑马鱼幼鱼和成鱼动物模型,以及巨噬细胞感染模型,从动物实验和细胞生物学实验水平分别比较了各个衍生物的活性差异,却发现体内实验和此前的体外实验结果存在一定的“不一致性”。经过仔细的分析推敲和实验论证,他们最终发现了一种此前不为人知的抗生素抗菌模式:TSR除了能够直接与细菌的核糖体结合从而抑制其蛋白质合成之外,还能够通过诱导宿主细胞的内质网应激,继而激活宿主细胞发生有利于自我防御和清除病原菌的生理过程——细胞自噬。TSR及其衍生物是目前发现的唯一一类能够主动作用于宿主和胞内寄生菌,并在杀灭病原菌的同时提高宿主免疫防御能力的抗生素。由于其作用靶点位置的特殊性,目前临床中尚未发现对于TSR的耐药菌,且相关报道中均未发现其具有明显的毒副作用。本研究中不但发现TSR具有治疗胞内寄生菌感染性疾病的潜力,还发现此前获得的三个衍生物均具有比母化合物更好的抗胞内菌活性,可能作为一类药物前体被临床工作者所重视,而这样一种同时作用于宿主和寄生菌的独特抗菌作用模式比起传统药物的抗菌机制更不易产生耐药性,也将为未来抗感染药物的设计给出新的启示。
该研究工作得到国家自然科学基金委、科技部、上海市科委和中国科学院的大力资助,也是上海有机所“三个重大”突破项目之一。
附件下载:

