

上海有机所D-A反应的生物催化机制研究取得重大突破
狄尔斯(Diels)-阿尔德(Alder)反应(简称D-A反应)是合成化学中最重要的反应类型之一。合成化学中的D-A反应屡见不鲜,而自然界中是否存在能够催化D-A反应的酶,多年来一直是生物学家和化学家争论和悬而未决的焦点科学问题。中国科学院上海有机化学研究所生命有机化学国家重点实验室刘文领导的团队,经过长达12年的努力,在螺环乙酰乙酸内酯/内酰胺抗感染抗生素的生物合成中发现了两种不同的酶,可以极大地促进[4+2]D-A环化反应的发生。该发现为证实D-A反应酶的天然存在提供了有力的证据。相关成果已于3月3日在线发表于《自然-化学生物学》杂志上。
D-A反应由德国化学家狄尔斯和他的学生阿尔德在1928年首次发现。它通过共轭双烯与取代烯烃直接反应,简捷、高效地构筑六圆环分子骨架,并且具有高度的化学、区域和立体选择性,因此被广泛应用于天然产物、药物、材料分子的合成,师生二人也因此获得了1950年的诺贝尔化学奖。因该类反应的发现而触发的理论研究,也导致了上世纪60年代在化学领域具有里程碑意义的“分子轨道对称守恒原理”和“前线分子轨道理论”的诞生,美国化学家霍夫曼和日本化学家福井谦一因此获得了1981年的诺贝尔化学奖。
作为一种碳碳键构建极为有效的手段,科学家们早已预言D-A反应可能参与了具有环己烯单元的大量天然产物的生物合成,并且通过人为进化的手段创造了能够催化简单D-A反应的抗体酶或核酶。但是,目前自然界中发现的能够促进[4+2]D-A环化反应的天然酶蛋白仅有5例;而它们在此类转化中是否存在催化功能的争论依旧,原因是这些酶或者具有多种功能,或者催化效率很低,或者相应的反应根本不需酶就可以自发进行,使得相关的机制研究尤为困难,导致数十年来人们无法确切地判断D-A反应酶到底是否天然存在。
刘文团队最近的发现为回答这一科学难题创造了有利的契机。在螺环乙酰乙酸内酯/内酰胺抗感染抗生素的生物合成中,两种不同的[4+2]D-A环化酶以催化串联反应的方式,将具有两套共轭双烯与亲双烯体单元的线性中间体有效地转化为单一对映体的刚性五环骨架。与之前的例证不同,在没有相应的酶蛋白存在下,上述具有高度区域和立体选择性的[4+2]环加成反应无法自发发生,同时所依赖的酶蛋白功能单一、效率高,是非常理想的验证D-A反应生物催化机制的研究对象。
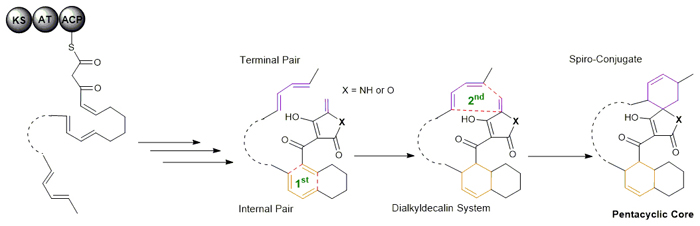
事实上,自然界中螺环乙酰乙酸内酯/内酰胺抗生素产生于各种来源的微生物,目前该家族已有数十个成员的化学结构得以确证。这些抗生素具有强烈的抗感染、肿瘤抑制等重要的生物活性,长期以来一直是生物学、药学和化学领域共同关注的研究热点。然而由于结构的复杂性,化学合成或修饰往往面临产率和效率方面的严峻挑战。刘文团队的研究发现,所有螺环乙酰乙酸内酯/内酰胺成员均采用了相似的生物合成策略,即通过酶促的[4+2]环加成反应完成线性中间体的刚性交联;两个不同酶催化的环化反应可以偶联也可以去偶联,从而解释了自然界中如何创造核心骨架相似、但整体结构不同的抗生素分子。可以预期,以两个酶催化的串联[4+2]环加成反应为中心的合成策略如能有效运用,将极大地促进以多样性为导向的生物和化学合成手段的发展,通过建立相应天然产物的类似物分子库,以应对药物化学研究中对于分子结构多样性的要求和化学生物学研究中对于特异性分子探针的制备需求。
该研究得到国家基金委和科技部的支持,也是上海有机所“三个重大”突破项目之一。
附件下载:

