

近期,中国科学院上海有机化学研究所生命有机化学国家重点实验室唐功利课题组和曹春阳课题组合作,首次报道了一类不依赖任何辅因子的TxnO9(CalC-like)为代表的蛋白,可以催化蒽并吡喃环类化合物中γ-吡喃酮的形成,并对其作用机制进行了深入研究(Angew. Chem., Int. Ed. 2018, 57, 13475)。
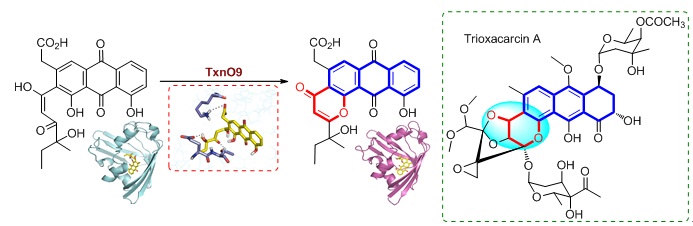
三欣卡辛是来源于链霉菌的具有良好抗肿瘤活性(IC50达到亚纳摩尔级别)的芳香聚酮类天然产物。前期的研究中克隆、分析了其生物合成基因簇,并通过体内敲除、中间体的鉴定等系列实验提出了其生物合成途径(Chem. Sci. 2015, 6, 3440),但是其中还有很多蛋白的功能是未知的。其中一个小蛋白(长度为152个氨基酸)TxnO9引起了我们的注意:它与CalC同源(36%),而CalC蛋白就是抗肿瘤化合物烯二炔类抗生素产生菌的抗性蛋白,通过自杀式淬灭自由基来保护宿主,由此推测TxnO9可能具有抗性功能。然而,这个通过生物信息学推测的具有潜在抗性的基因txnO9后来被证实是三欣卡辛生物合成途径中的一个关键基因,其编码蛋白催化O-杂环化和脱水两步反应而形成γ-吡喃酮。而这种酶催化方式与之前报道的关于γ-吡喃酮的形成机制完全不同。
为了阐明TxnO9的催化机理,与生命有机国家重点实验室曹春阳课题组合作,利用核磁技术解析了TxnO9自由态、TxnO9与底物类似物及产物类似物复合物的结构。结果表明TxnO9属于START家族,但是结构特征与该家族研究比较清楚的TcmN、CalC等不同,这也与它们的催化功能不同相一致。根据蛋白与复合物的结构,结合定点突变结果提出了K10锚定底物、T146和E145协助催化的机制。鉴于数据库中其同源蛋白功能都是未知的,选择来源于Microtetra sporaglauca, Thermomono sporacurvata和Kitasato sporagriseola的同源蛋白Mic、Therm、Kit以及Hedmycin生物合成基因簇中HedB的N-端蛋白开展体外生化研究,结果表明它们都具有TxnO9类似的催化功能。这些蛋白形成了一个不同于START家族中生理调节功能蛋白(MLN64,Bet v1)、环化芳香化功能(TcmN为例)及CalC抗性功能蛋白的全新的亚家族。该研究工作一方面阐明了三欣卡辛中吡喃环的形成方式,另一方面丰富了START家族酶的功能。
上述研究成果主要由唐功利课题组的侯现锋副研究员和曹春阳课题组的宋玉娇博士等人完成。这一工作得到了国家自然科学基金委、中国科学院战略性先导科技专项(B类)等经费的大力资助。
附件下载: