

苄位手性季碳中心结构广泛存在于众多天然产物及具有药物活性的分子结构中,然而此类手性骨架的高效合成一直以来是有机化学界中的难题。钯催化芳基卤代物和羰基化合物之间的不对称α-芳基化反应是合成苄位手性季碳中心结构的较为理想而又简便的方法,但是现有合成方法仍然具有较大的局限性,尤其对具有较大位阻的芳基卤化物反应产率和立体选择性均不理想, 限制了不对称α-芳基化反应在天然产物和药物分子合成中的广泛应用。紫堇,又名蝎子花、断肠草,罂粟科植物,有清热解毒、杀虫止痒等功效。紫堇灵(Corynoline)为紫堇中主要成分,为乙酰胆碱抑制剂,具有显著的镇静和抗钩端螺旋体的作用。然而天然产物中两种对映体均存在,现在仍然缺乏对光学纯紫堇灵的药理研究。一个重要的原因是缺乏对光学纯紫堇灵的高效不对称合成方法。

中国科学院上海有机化学研究所生命有机化学国家重点实验室汤文军课题组近年来注重发展手性单膦配体促进的大位阻不对称交叉偶联反应。基于手性单膦配体在大位阻芳基芳基偶联反应中显示出来的优秀活性和立体选择性,课题组的饶小峰博士、李乃凯博士和柏珩同学成功地将手性BI-DIME配体应用于钯催化的大位阻α-芳基化反应中,在温和的反应条件(80℃)以及较低的催化剂用量(1 mol%)下,合成了一系列具有苄位手性季碳中心结构、大位阻的芳香环酮衍生物(图一)。
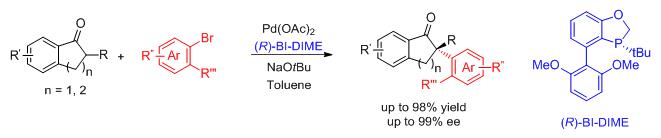
图一:Pd-BI-DIME催化大位阻的不对称α-芳基化反应
研究团队以不对称α-芳基化反应为主要合成策略,从简单易得的原料出发仅5步实现了(-)-紫堇灵的高效不对称合成 (图二)。5,6-亚甲基缩醛茚酮 1 和芳基溴化物2在Pd-(S)-BI-DIME 的催化作用下偶联,以70%的收率、92%的立体选择性实现手性环酮3的制备。接着,自由基双溴化以及与甲胺亲核取代两步反应成功构建哌啶环,生成多环结构5。一个巧妙的Büchner–Curtius–Schlotterbeck增碳反应实现了Corynolon 6的成功构筑, 最后一步LAH还原顺利完成(-)-紫堇灵的高效不对称合成。另外,研究团队仅以3步反应制备了同样具有重要生理活性的deN-Corynoline,并仅用4步合成了天然产物(+)-Sceletium A-4。此项工作将积极促进具有手性季碳中心结构的天然产物和药物的高效合成和药理研究。
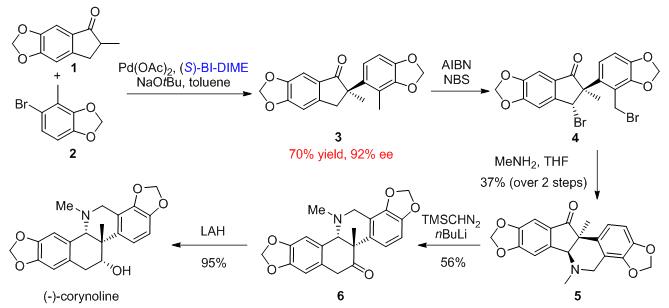
图二:天然产物(-)-紫堇灵的高效不对称合成
该工作近期发表在《德国应用化学》上(Angew. Chem., Int. Ed. 2018, DOI:10.1002/anie.201807302),饶小峰、李乃凯和柏珩为共同第一作者,中科院上海有机化学研究所为第一单位。 该研究工作得到国家自然科学基金委、中国科学院战略性先导科技专项(B类)、中国科学院、上海科委以及生命有机化学国家重点实验室的大力资助。
附件下载: