

含手性季碳的三环骨架广泛存在于甾体和萜类天然产物中,而且这一类天然产物表现出丰富的生理活性。例如,贝壳杉烯 (Kaurene) 是赤霉素生物合成的前体; 同化激素宝丹酮 (Boldenone) 是一种合成代谢类固醇;陶塔二酚 (Totaradiol) 是一种抗菌性二萜类天然产物。如何高效地构建这类含手性季碳三环骨架一直是有机化学中的一个热点和挑战。过渡金属催化的不对称Heck环化反应是一种常用的高效构建含手性季碳多环骨架的方法。然而这种方法也存在局限性,有时底物中的烯烃需要多步来合成,有时Heck环化产物需要多步转化生成天然产物。
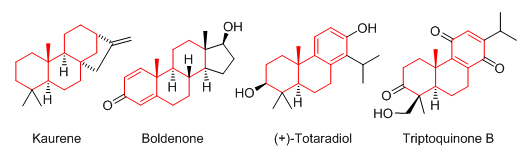
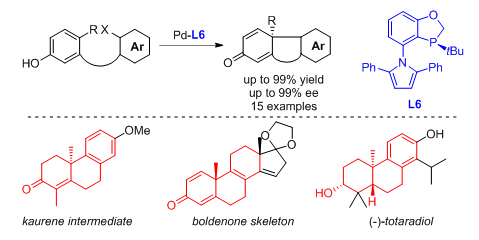
生命有机国家重点实验室杜康、郭盼、陈远、曹振利用手性单膦配体成功地发展了分子内两个芳基间的不对称去芳构偶联,实现了对含有手性季碳中心的菲酮类三环结构的高效不对称构筑。这个不对称环化方法学比起不对称Heck环化反应的优点在于:1)原料由简单的芳基化合物出发,容易制备;2)环化反应更接近一系列天然产物。利用该策略,他们从简单的原料出发四步合成了贝壳杉烯中间体,比起已报道的14步不对称Heck环化策略极大地提高了合成效率;同时运用于同化激素宝丹酮骨架的高效构筑;最后完成了陶塔二酚的高效不对称全合成。此项工作以热点文章发表在《德国应用化学》上 (Angew. Chem. Int. Ed. 2015, 54, 3033)。
此项研究工作得到国家青年千人计划、国家自然科学基金委、上海市科委和中国科学院的大力资助。
附件下载: