

γ-谷氨酰基转肽酶(γ-glutamyltranspeptidase,γ-GT)属于N端亲核水解酶(N-terminalnucleophile (Ntn)hydrolase)超家族,该家族中所有已知的成员均催化碳-氮键的断裂反应。该类蛋白表达后产生的前体肽没有催化活性,需要经过自催化断裂形成异源二聚体才具有催化活性。γ-GT主要催化小分子硫醇谷胱甘肽(glutathione,GSH)及其衍生物的γ-谷氨酰基转移/水解反应,在细胞内参与广泛的抗氧化、解毒和抗炎症等生理过程。革兰氏阳性的放线细菌中不存在GSH的相关代谢,但却存在大量注释为γ-GT的蛋白,推测这些注释为γ-GT的蛋白并非参与GSH的代谢过程,可能具有独特的酶学功能。近日,中国科学院上海有机化学研究所生命有机化学国家重点实验室刘文研究员课题组在国际上报道了γ-GT同源蛋白催化碳-碳键断裂的新功能,相关成果发表于《自然•通讯》上(Nat. Commun.2017, 8, 16109)。
多种放线细菌来源的天然产物,如林可霉素(lincomycin)、安曲霉素(anthramycin)、西伯利亚霉素(sibiromycin)、妥梅霉素(tomaymycin)等均含有4-烷基-L-(脱氢)脯氨酸(4-alkyl-L-(dehydro)proline,ALDP)的非天然氨基酸单元。研究人员发现,一组注释为γ-GT的同源蛋白参与了ALDP的生物合成过程。他们以林可霉素的产生菌林可酰胺链霉菌作为模式体系,表征了两个γ-GT同源蛋白。这两个蛋白均可以通过分子内肽键的断裂而自我激活,产生的两个蛋白亚基形成有功能的异源二聚体,并暴露出位于大亚基N-端的苏氨酸残基作为亲核试剂以介导ALDP生物合成中的一步关键的C-C键断裂反应。这是放线细菌中γ-GT同源蛋白的首次功能解析,也是Ntn水解酶催化C-C键断裂反应的第一例报道。相关研究拓展了对于γ-GT和Ntn水解酶超家族的认识,代表了酶催化C-C键断裂反应的一种新机制。刘文课题组长期以来致力于林可霉素的生物合成机制研究,此次发现是相关人员继揭示小分子硫醇的建设性角色(Nature2015, 518, 115-119)和磷酸吡哆醛(pyridoxal phosphate,PLP)依赖的硫缀多样化修饰(J. Am. Chem. Soc.2016, 138, 6348-6351)以来取得的又一突破。
上述成果由博士生钟冠男等完成,并获得了国家自然科学基金委、上海市科委和中科院等相关项目的大力资助。
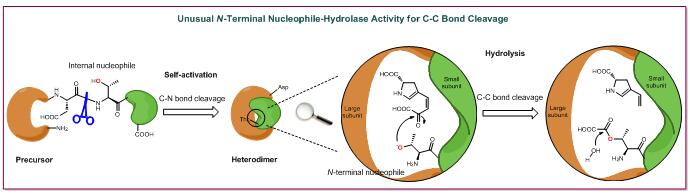
N端亲核水解酶催化C-C键的断裂反应
附件下载: