

近期,中国科学院上海有机化学研究所生命有机化学国家重点实验室刘文研究员课题组在国际上首次阐明了 35 元大环硫肽类抗生素sulfomycins中聚唑结构的形成机制,相关成果已于4月15日在线发表于《美国化学会志》上(J. Am. Chem. Soc. 2020, DOI: 10.1021/jacs.0c02329 )。
硫肽类抗生素是一类由微生物次级代谢产生的聚肽类天然产物,大多具有良好的抗革兰氏阳性菌以及抗肿瘤活性。近年来,人们发现在人体共生微生物也能够产生硫肽分子,提示硫肽类抗生素的生物合成可能直接影响共生细菌与人体的互作关系,有利于维持人体健康,对于新药开发具有重要的导向意义。早期生物合成研究揭示该类分子由核糖体合成并经过翻译后修饰得到,其核心骨架大环的构筑过程涉及到三个关键的翻译后修饰反应,即环化脱水/脱氢(形成唑类五元杂环)、丝氨酸/苏氨酸脱水(形成脱水氨基酸)以及杂原子[4 + 2]环加成反应(核心骨架大环的大环化)。鉴于该类天然产物具有复杂的分子结构,其往往难以通过化学全合成得到。因此,对于硫肽类抗生素的生物合成研究将有助于这类化合物的深度开发和利用。
刘文课题组长期以来致力于硫肽类抗生素的生物合成研究(Nat. Prod. Rep. 2013, 30, 218–226; Curr. Opin. Chem. Biol. 2013, 17, 626-634; Org. Biomol. Chem. 2017, 15, 3376–3390; Curr. Opin. Biotechnol. 2017, 48, 210–219)。最近,该课题组以 35 元大环硫肽类抗生素 sulfomycins为研究对象,发现了一个非线性的两阶段过程负责完成了分子中五个唑类杂环的引入。在第一阶段中,由双结构域E1-YcaO蛋白和F伴侣蛋白组成的典型环化脱水酶复合物,将两个相距较远的残基(L-Cys2和L-Thr9)杂环化,随后异源三聚体脱氢酶再将所得的唑啉转化为唑。在第二阶段中,脱氢酶三聚体与另一个离散的YcaO蛋白结合形成非典型的四组分唑类合成酶复合物,该复合物依次将余下三个残基L-Cys7、L-Thr5和L-Ser12转化为唑。E1伴侣蛋白在两个阶段中均起着至关重要的作用,它介导了各种特定的蛋白-蛋白相互作用。这项研究加深了对于含唑类核糖体肽生物合成的理解,同时对聚唑形成的翻译后修饰逻辑研究具有重要意义。四组分唑类合成酶复合物常见于35 元大环硫肽类抗生素,因此该研究成果将有助于利用基因组挖掘和合成生物学方法发现、改造和创建新硫肽。
上述成果获得了国家自然科学基金委、科技部、上海市科委和中科院等相关项目的大力资助。
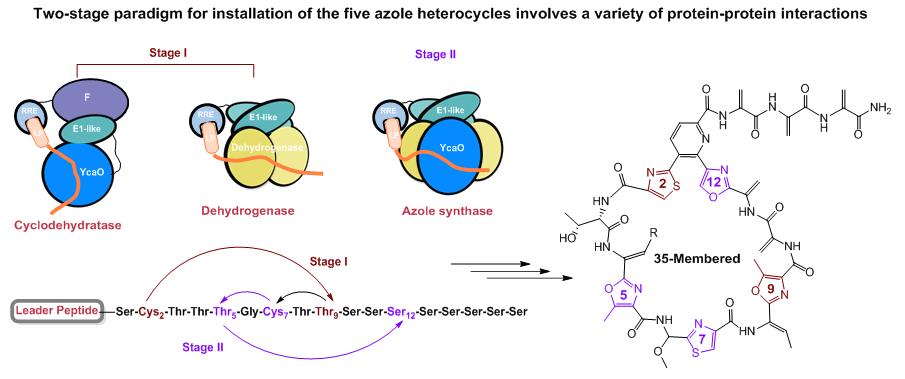
多个蛋白复合物参与sulfomycins中聚唑的形成机制
附件下载: