

硫肽类抗生素是一类富含元素硫、结构被高度修饰的大环聚肽类天然产物,迄今为止已有大约100个天然成员被发现。这类抗生素选择性地作用于细菌的核糖体,从而抑制其蛋白质的合成;部分成员对于具有多种耐药性的条件致病菌杀伤效果良好,近年来由于细菌耐药性的日益泛滥引起了医药界的高度重视。此外,随着硫肽类抗生素强烈的抗疟、抗肿瘤以及免疫抑制等活性的陆续报到,如何通过结构的衍生克服其理化性质的缺陷(如由于水溶性差带来的较低生物利用度等)以满足临床应用的需要成为了当前研究的重点之一。
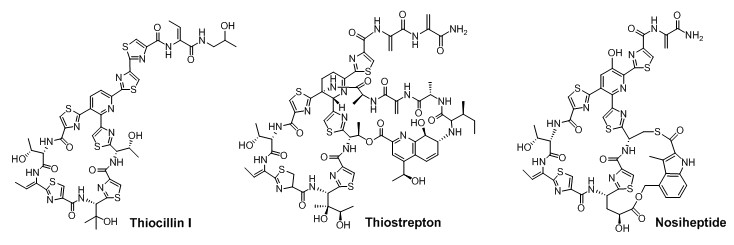
硫肽类抗生素的结构非常复杂而独特,所有成员都拥有一个3位或4位取代的6元含氮杂环、由多个脱水氨基酸和噻唑环或咪唑环所构成的环肽中心。自1948年首个成员被发现以来,这类抗生素生物合成的起源一直存在争论。2009年,我课题组与国际上其他研究者一道,揭示了硫肽类抗生素核糖体肽的生源途径,显示:尽管结构高度复杂,其成员均是以一条长约35-50aa的前体肽为底物,通过保守的翻译后修饰来形成共有的特征性环肽骨架。这一发现为通过底物前体肽的序列重排改变硫肽的环肽骨架以创造新的该家族成员奠定了分子基础。近期,课题组在英国皇家化学会杂志《Natural Product Reports》上,应邀对采用生物合成策略实现硫肽结构的衍生进行了总结(Nat. Prod. Rep. 2013, 30, 218-226)。由于分子结构的复杂性,采用化学合成的方法进行硫肽结构的衍生极具挑战。
研究表明,将前体肽底物转化为硫肽分子的特征性骨架结构需要以下翻译后修饰的化学反应:由环化脱水酶/FAD-依赖脱氢酶催化的聚噻唑或恶唑的形成;来源于丝氨酸或苏氨酸、由脱水酶负责的脱水氨基酸的合成;以及线性中间产物通过分子内的【4 + 2】环化反应形成含氮6元杂环核心、同时完成大环骨架的构建。然而,这些共同的翻译后修饰反应尚未在体外得以重构。除了一些实验技术方面的原因(包括高质量酶蛋白的制备和不稳定线性肽类中间产物的阐明等),对于硫肽分子的生物合成逻辑缺乏足够的认识是目前主要的障碍。课题组在综述性杂志《Current Opinion in Chemical Biology》上,以诺丝七肽(Nosiheptide,NOS)作为模式分子对于硫肽生物合成逻辑研究中存在的机遇和挑战进行了系统分析,同时预测:在组合共有的修饰策略形成特征性的硫肽骨架过程中,可能穿插了一些不可或缺的特异性翻译后修饰反应(Curr. Opin. Chem. Biol. 2013, 17, 626-634)。
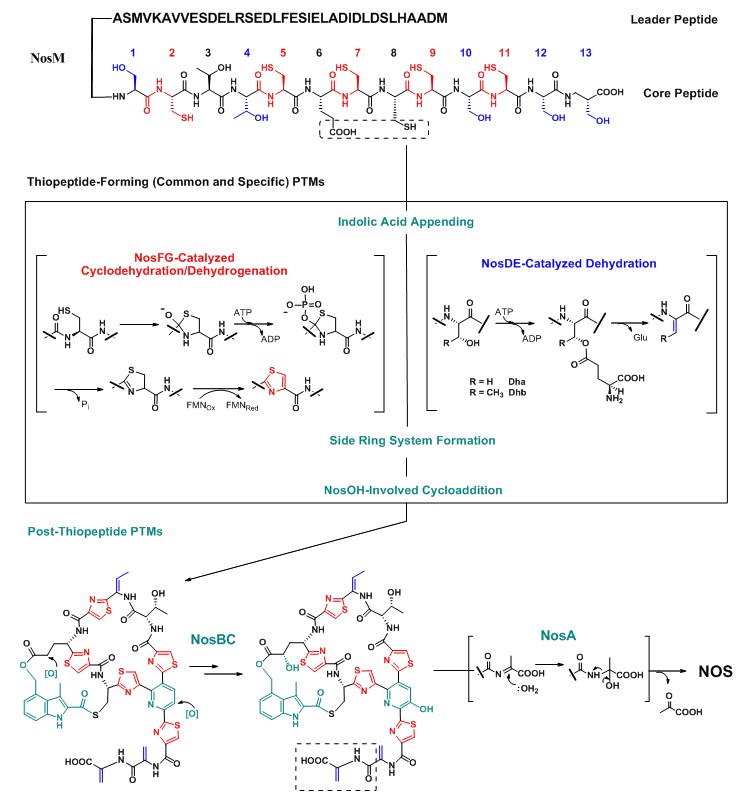
最近,课题组的郭恒助理研究员等为上述预测提供了有力的实验证据。研究者在一株诺丝七肽的突变菌株中,分离获得了一个吲哚侧环已经构建而环肽主体骨架尚未形成的线性化合物。阻断吲哚单元的上载则完全终止了硫肽抗生素的产生,显示对于双环硫肽成员的诺丝七肽而言,核心6元杂环的合成(即硫肽特征性骨架的构建)依赖于前体肽上吲哚单元上载的特异性翻译后修饰。这一发现揭示了以共有和特异性翻译后修饰反应的相互依赖与交叉为特征、高度复杂的硫肽生物合成逻辑,为在体外实现硫肽骨架的重构、解析其催化反应的顺序和机制创造了条件,于近期在线发表于英国皇家化学会综合性杂志《Chemical Science》上(Chem. Sci. 2013, DOI: 10.1039/C3SC52015C)。
上述研究成果受到国家自然科学基金委、科技部、上海市科委、中科院、上海有机化学研究所“一三五”战略规划和生命有机国家重点实验室的大力资助。
附件下载: