

α-突触核蛋白(α-synuclein,α-syn)的淀粉样相变聚集是帕金森病(Parkinson’s disease,PD)的核心病理特征之一。α-Syn病理性聚集体能够在神经元之间传播,破坏细胞内的蛋白质稳态,干扰自噬途径,并诱导神经炎症与细胞死亡。近年来,刘聪课题组参与发现了多个关键蛋白(如膜受体LAG3、APLP1和RAGE,以及自噬关键蛋白LC3B等)通过特异性结合α-syn病理聚集体介导了这些不同的病理过程1-3。此外,研究鉴定出α-syn聚集体的C末端以无序结构状态覆盖在病理纤维聚集体的表面,成为纤维聚集体与不同蛋白识别结合的关键区域1,4,5。因此,发展小分子靶向C末端无序区,阻断α-syn病理聚集体与相应受体蛋白的互作,有望为PD药物研发和治疗提供潜在的新方向。

近日,中国科学院上海有机化学研究所生物与化学交叉研究中心/生命过程小分子调控全国重点实验室刘聪研究员、谭立研究员与中国科学技术大学项晟祺教授合作,在Journal of the American Chemical Society发表了题为“Inhibitor Development for α‑Synuclein Fibril’s Disordered Region to Alleviate Parkinson’s Disease Pathology”的研究文章。该研究通过高通量筛选与理性设计,首次发现了能够结合α-syn病理纤维C末端关键无序区的活性小分子Givinostat(GS)及其衍生物。相应的活性小分子能有效阻断病理纤维与LAG3和RAGE等关键受体的相互作用,并抑制α-syn纤维在神经元中的病理性传播及其促炎症效应。候选化合物展现出良好的临床应用潜力,为PD的治疗提供了全新策略。
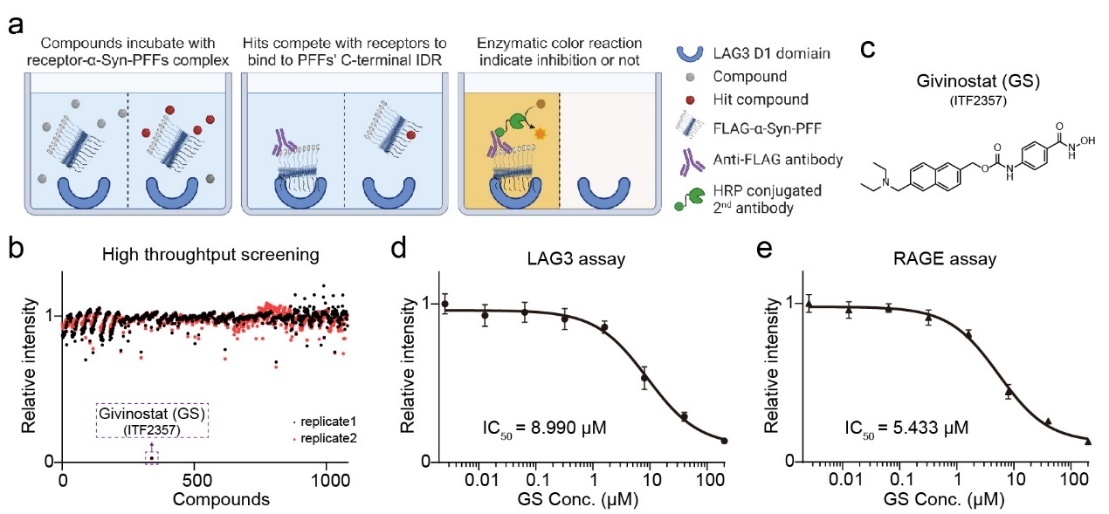
图1.高通量筛选鉴定Givinostat(GS)分子能够阻断α-syn纤维与受体的结合
在本研究中,研究人员首先建立了基于酶联免疫吸附实验(ELISA)的高通量筛选方法,旨在寻找能够阻断α-syn病理纤维C末端关键无序区与受体结合的小分子抑制剂(图1a)。通过该方法,Givinostat(GS)被筛选为主要候选分子(图1b-c),进一步的活性验证表明,GS能够有效抑制α-syn C末端无序区与LAG3和RAGE受体的直接相互作用(图1d-e)。
研究人员进一步开展了结构-活性关系研究(SAR)。首先,对GS的关键结构单元进行了系统优化,GS的结构主要由两部分组成:(1)锌结合的异羟肟酸基团,(2)增强选择性的功能基团(图2)。在优化过程中,GS被分为A-E五个部分,并逐步进行调整。最初尝试替换E部分的异羟肟酸基团或对其进行修饰,但这些改动均导致分子活性丧失或大幅下降,进一步确认了异羟肟酸基团的关键作用。然而,对其位置的调整(如meta位类似物)成功保留了活性,同时降低了毒性。D部分引入给电子/吸电子基团未显著改变活性,但C部分的改造表明,用脲基替换氨基甲酰键可提高化学稳定性。最终,通过对B和A部分的进一步修饰,优化出了如GSD-16-24等具有更强抑制效果的化合物,并显著降低了其对神经元的毒性。
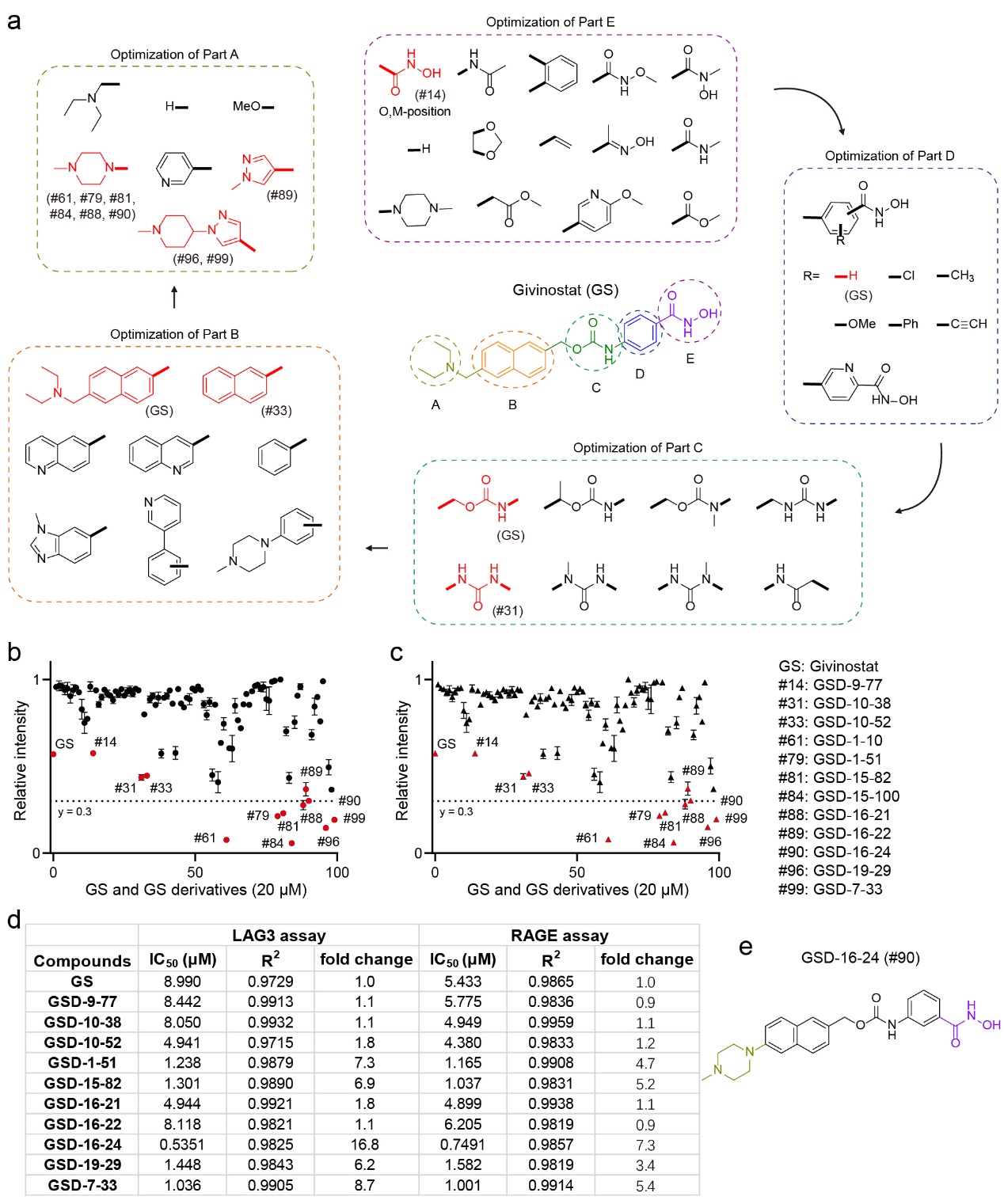
图2. 通过结构-活性关系研究(SAR)设计GS的系列衍生物。
在机制研究中,研究人员首先通过等温滴定量热法(ITC)发现,GS及其衍生物GSD-16-24直接作用于α-syn纤维的C末端无序区域,而非作用于LAG3和RAGE受体。随后,研究人员通过液态核磁共振、固态核磁共振及冷冻电镜等技术,进一步揭示了GSD-16-24与α-syn纤维C末端无序区域中具体的氨基酸相互作用位点,并发现这些结合位点与α-syn纤维结合受体的位点高度重合,表明GSD-16-24通过与受体直接竞争发挥抑制作用(图3)。细胞实验表明,GSD-16-24能够有效阻止α-syn纤维与原代皮层神经元及BV2细胞的结合,从而抑制纤维在神经元中的传播及其促炎症效应。

图3. 通过冷冻电镜和固态NMR等实验确定GSD-16-24结合于α-syn纤维的C末端无序区域。
综上所述,本研究首次实现了特异性靶向α-syn病理纤维核心外围无序结构区的小分子化合物的设计和研发,并通过活性分子阻断α-syn病理纤维与神经元及小胶质细胞膜受体的结合,有效抑制纤维的传播和神经炎症活性。这一研究为靶向病理蛋白无序区的小分子抑制剂的设计与研发奠定了基础,并为开发具有帕金森病治疗潜力的小分子药物提供了新的思路。
上海交通大学Bio-X研究院研究生章沈庆、陶友琦博士及中国科学院上海有机化学研究所生物与化学交叉研究中心博士生项淮江,以及中国科学技术大学生命科学学院李娟博士为该论文的共同第一作者。刘聪研究员、谭立研究员与项晟祺教授为共同通讯作者。本项目得到了国家自然科学基金委、中国科学院及上海市科委的支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/jacs.4c08869
参考文献:
1 Zhang,S. et al. Mechanistic basis for receptor-mediated pathological α-synuclein fibril cell-to-cell transmission in Parkinson's disease. Proc Natl Acad Sci U S A118 (2021). https://doi.org:10.1073/pnas.2011196118
2 Long,H. et al. Interaction of RAGE with α-synuclein fibrils mediates inflammatory response of microglia. Cell Rep40,111401 (2022). https://doi.org:10.1016/j.celrep.2022.111401
3 Xu,Q. et al. α-Synuclein amyloid fibril directly binds to LC3B and suppresses SQSTM1/p62-mediated selective autophagy. Cell Res (2024). https:// doi: 10.1038/s41422-024-01022-2
4 Li,Y. et al. Amyloid fibril structure of α-synuclein determined by cryo-electron microscopy. Cell Res28,897-903 (2018). https://doi.org:10.1038/s41422-018-0075-x
5 Zhang,S. et al. Conformational Dynamics of an α-Synuclein Fibril upon Receptor Binding Revealed by Insensitive Nuclei Enhanced by Polarization Transfer-Based Solid-State Nuclear Magnetic Resonance and Cryo-Electron Microscopy. J Am Chem Soc145,4473-4484 (2023). https://doi.org:10.1021/jacs.2c10854
附件下载: