

细胞自噬是几乎所有哺乳动物细胞正常运行所必需的一种重要分解代谢过程,其在细胞内稳态的维持、胚胎发育、天然免疫、衰老等众多的生理过程中扮演着重要的角色。同时,细胞自噬的功能异常与大量的人类疾病密切相关,比如癌症和神经退行性疾病等。TAX1BP1作为一个可结合泛素的多功能自噬受体蛋白,在降解入侵病原体、蛋白聚集体、受损溶酶体等选择性自噬过程中扮演着重要角色。中科院上海有机化学研究所生命过程小分子调控全国重点实验室的潘李锋课题组长期致力于TAX1BP1等自噬受体蛋白的结构和作用机制研究。课题组前期的相关研究工作系统阐明了自噬受体蛋白TAX1BP1识别泛素蛋白、脚手架蛋白NAP1和分子马达蛋白Myosin VI相关的结构基础和分子机制(Journal of Molecular Biology. 2018, 430, 3283-3296;PNAS. 2018, 115, E11651-E11660; Nature Communications. 2019, 10(1):3459)。
近期,潘李锋课题组在美国科学院院刊(PNAS)在线发表了题为“Mechanistic insights into the interactions of TAX1BP1 with RB1CC1 and mammalian ATG8 family proteins”的研究论文(https://www.pnas.org/doi/10.1073/pnas.2315550121)。该团队首先利用核磁共振、等温量热滴定、光谱位移等多种实验方法,详细研究了自噬受体蛋白TAX1BP1与自噬起始ULK复合物亚基RB1CC1之间的相互作用,首次发现TAX1BP1采用双位点作用的模式结合RB1CC1,除了已知的TAX1BP1的SKICH结构域能结合RB1CC1的coiled-coil结构域之外,TAX1BP1的coiled-coil结构域也可以与RB1CC1的C端区域(CTR)发生相互作用,并且RB1CC1的两个结合位点在结合TAX1BP1时并不采用协同的作用模式。因此,RB1CC1和TAX1BP1之间的双位点结合模式赋予了RB1CC1和TAX1BP1形成动态寡聚物的能力。随后,利用X射线单晶衍射技术,该团队首次解析了TAX1BP1SKICH/RB1CC1 coiled-coil复合物的晶体结构,并基于该团队过去解析的TAX1BP1的SKICH结构域结合NAP1的复合物结构(PNAS. 2018, 115, E11651-E11660),发现TAX1BP1的SKICH结构域采用完全不同的区域和作用模式去结合RB1CC1和NAP1。有趣的是,后续的研究表明,RB1CC1的coiled-coil和NAP1的coiled-coil会通过别构效应竞争结合TAX1BP1的SKICH结构域,并且NAP1的FIR模序的引入可以介导稳定的RB1CC1/TAX1BP1/NAP1三元六聚复合物的形成。进一步通过相关的生化实验,该团队证实RB1CC1/TAX1BP1/NAP1三元复合物的结合模式为NAP1通过其FIR模序和N端的coiled-coil结构域同时招募RB1CC1和TAX1BP1,并且TAX1BP1/NAP1/RB1CC1三元复合物可进一步与TBK1激酶组装形成四元复合物。此外,该团队首次解析了TAX1BP1的非经典LIR(CLIR)基序结合哺乳动物ATG8家族蛋白GABARAP的复合物结构,详细阐明了TAX1BP1通过其CLIR模序选择性识别ATG8家族蛋白的分子机制。最后,该团队还发现单独的TAX1BP1、TAX1BP1/RB1CC1二元复合物、TAX1BP1/NAP1/RB1CC1三元复合物与ATG8家族蛋白的结合能力不同,并通过相关的生化实验和结构建模探讨了其中的潜在机制。
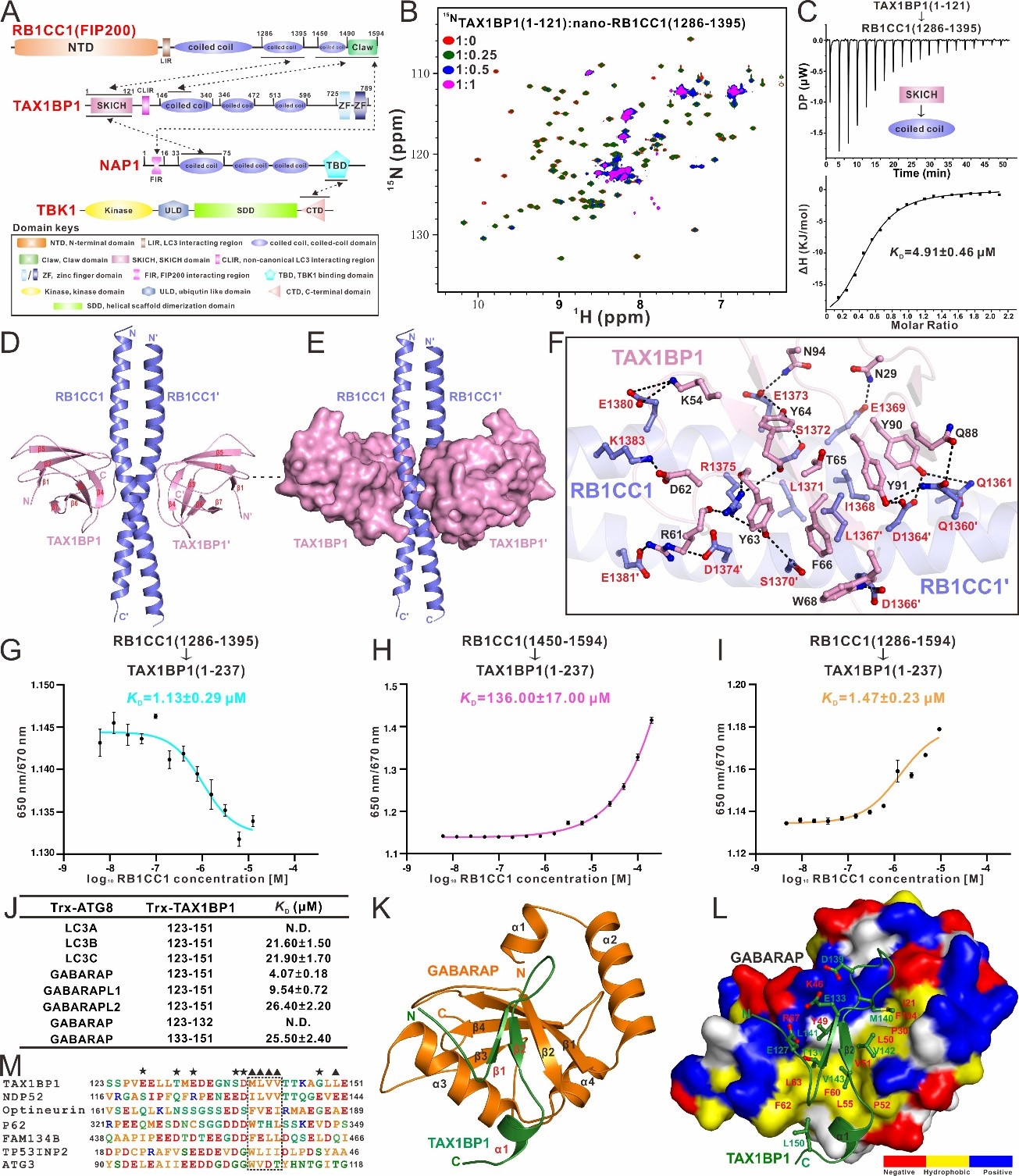
图1.TAX1BP1结合RB1CC1和ATG8家族蛋白的分子机制
综上所述,该研究工作系统地研究了自噬受体蛋白TAX1BP1结合ATG8家族蛋白以及自噬起始ULK复合物亚基RB1CC1的分子机制及其相关的蛋白相互作用网络,从结构角度首次揭示了TAX1BP1结合ATG8家族蛋白和RB1CC1的独特分子机制,并阐明了TAX1BP1、RB1CC1、NAP1、ATG8家族蛋白之间的相互关系。相关的研究结果表明,自噬受体蛋白TAX1BP1在识别泛素化自噬底物后可能先通过双位点模式结合RB1CC1进而招募ULK复合物。其中,TAX1BP1和RB1CC1之间的相互作用不仅阻碍了TAX1BP1的CLIR基序与ATG8家族蛋白的结合,而且还可能导致ULK复合物寡聚并激活ULK复合物,从而原位诱导自噬前体的产生。随后,TAX1BP1通过NAP1蛋白招募NAP1/TBK1复合物。其中,NAP1的引入将导致TAX1BP1和RB1CC1之间的相互作用发生重排,进一步形成ULK/TAX1BP1/NAP1/TBK1超级复合物,并且释放TAX1BP1的CLIR基序去结合锚定在自噬前体膜上的ATG8家族蛋白,进而促进后续自噬体的形成。总之,该研究工作从生化和结构角度对TAX1BP1、NAP1、RB1CC1、ATG8家族蛋白间相互作用的分子机制提供了新见解,扩展了领域内对于自噬受体蛋白TAX1BP1介导的选择性自噬过程的分子机制的认识。
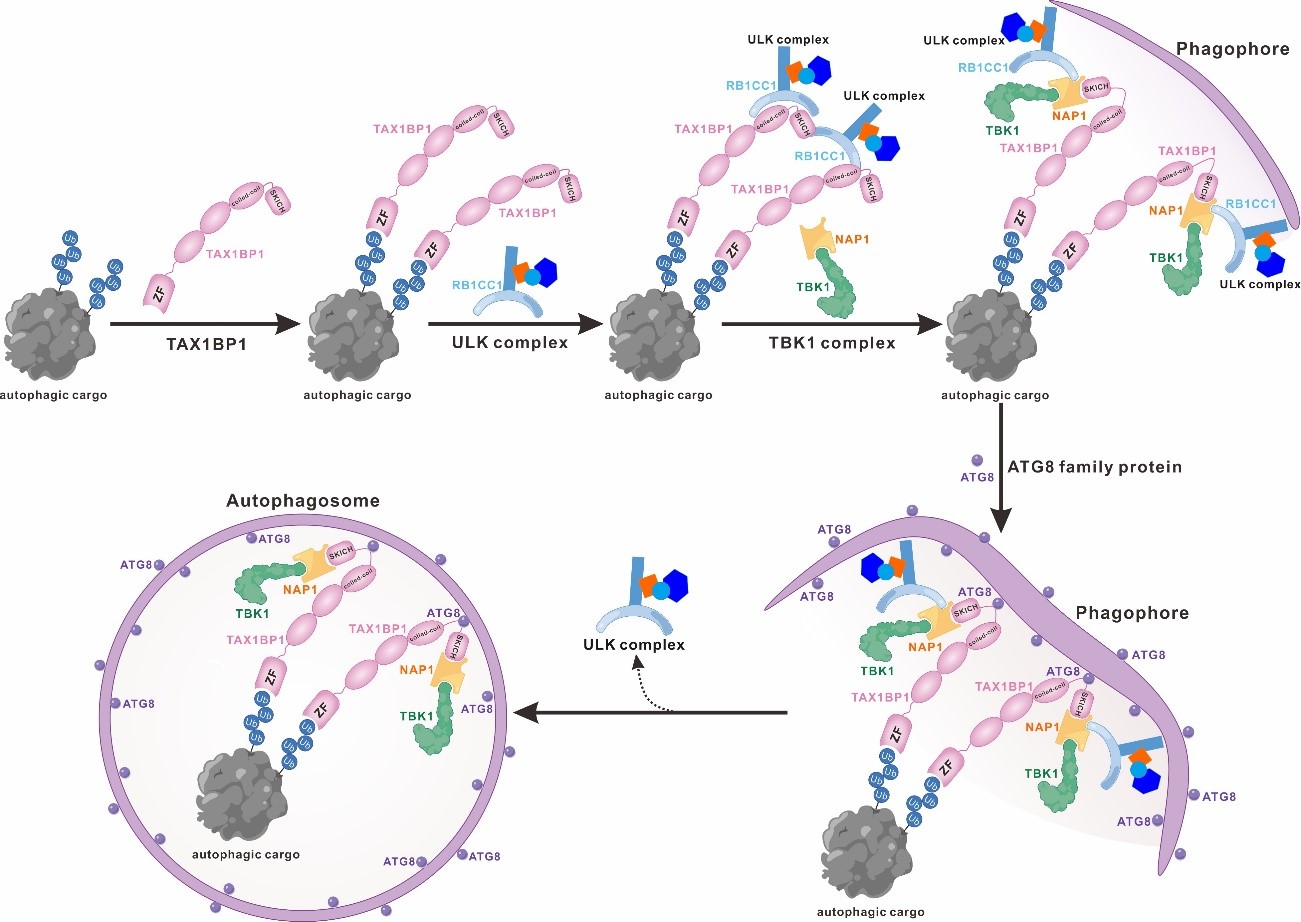
图2.TAX1BP1在选择性自噬过程中招募ULK、TBK1复合物以及ATG8家族蛋白的工作模式图
潘李锋课题组已毕业的张明芳博士为本文的第一作者。上述研究工作得到国家自然科学基金委、科技部国家重点研发专项项目、上海市科委、中国科学院青年交叉团队项目和生命过程小分子调控全国重点实验室的资助。
附件下载: