

泛素化修饰是哺乳动物细胞中广泛存在的一种蛋白质翻译后修饰,包括单泛素化修饰和不同连接方式的多泛素化修饰,在众多的细胞过程中发挥关键作用,包括蛋白质降解、细胞自噬、DNA修复、信号传导等。其中,线性泛素化修饰参与多种免疫相关过程,如NF-kB信号通路和抗入侵病原体的选择性自噬等。线性泛素链组装复合物(LUBAC)是目前已知的唯一一个可以介导线性泛素化修饰的E3泛素连接酶复合体,由一个催化亚基HOIP和两个调节亚基HOIL-1L和SHARPIN所组成。其中,HOIL-1L作为一个独特的RBR类型的E3泛素连接酶,可催化相关蛋白和糖类底物的单泛素化修饰,并可调控HOIP的线性泛素化活性。LUBAC的功能异常在小鼠模型和人身上都会引起免疫系统紊乱,并导致多种人类免疫相关的疾病。此外,HOIL-1L的E3酶活性的缺失会导致有害的聚葡萄糖体在人体心肌和脑组织中的累积,并引起心肌病、支链淀粉病等疾病。中国科学院上海有机化学研究所生命有机化学国家重点实验室的潘李锋研究组长期致力于LUBAC的作用机制和调控机理研究。课题组前期的相关研究工作系统阐明了SHARPIN结合HOIP进而激活HOIP的分子机制(Cell Reports. 2017, 21(1), 27-36),并首次揭示了致病福氏志贺氏菌(S. flexneri)的E3效应蛋白IpaH1.4/2.5采用多种“伎俩”破坏LUBAC的作用机制(PNAS. 2022, 119(12), e2116776119)。
近期,潘李锋研究组在Science Advances发表了题为“Mechanistic insights into the enzymatic activity of E3 ligase HOIL-1L and its regulation by the linear ubiquitin chain-binding”的研究论文(https://www.science.org/doi/10.1126/sciadv.adi4599)。在该项研究中,该团队首先综合利用液体核磁共振和X射线单晶衍射技术,成功解析了HOIL-1L的催化核心区域(IBR-RING2)的晶体结构,发现其RING2结构域中存在一个新颖的Zn2-Cys6双核簇。进一步结合相关的生化实验,确定了HOIL-1L中非常独特的催化三联组,并发现HOIL-1L完整的RBR模块连同NZF结构域可作为一个整体发挥其E3酶活性,介导相关蛋白和糖类底物的单泛素化修饰。同时,该团队利用等温量热滴定、分析型超速离心等技术,揭示了HOIL-1L的NZF和RBR区域含有两个不同的线性泛素二聚体的结合位点,其可协同结合线性泛素四聚体,并且该相互作用可以显著地增强HOIL-1L的E3酶活性。随后,利用X射线单晶衍射技术,该团队进一步首次解析了HOIL-1L和线性泛素四聚体的复合物晶体结构,详细阐明了HOIL-1L识别线性泛素四聚体的分子机制。同时,基于相关的结构分析、生化和细胞生物学实验,该团队发现了HOIL-1L中独特的变构泛素结合位点,线性泛素链在该位点的结合会诱导变构效应,显著促进HOIL-1L的E3酶活性,进而影响HOIP的线性泛素化活性。
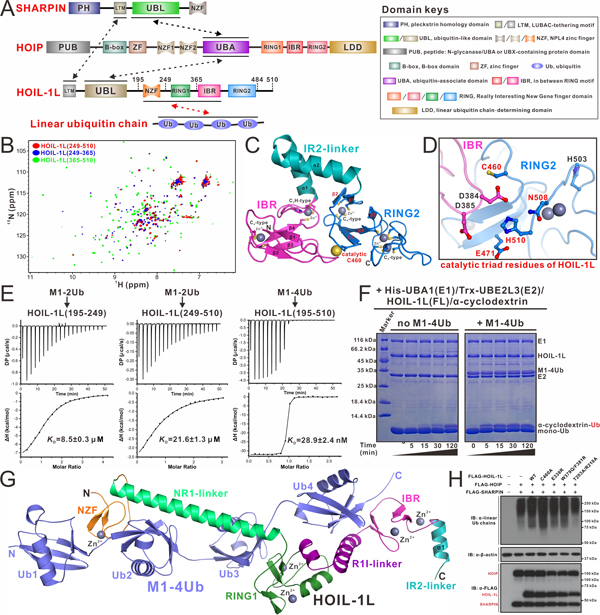
图1. HOIL-1L发挥E3酶活性以及结合线性泛素四聚体的分子机制
综上所述,该研究工作通过系统的生化和结构研究详细揭示了HOIL-1L发挥E3酶活性的作用机制及其受线性泛素链结合调控的分子机理。据此,该团队也对HOIL-1L在线性泛素链存在条件下,催化底物单泛素化修饰过程提出了一个作用模型:HOIL-1L通过其NZF-IBR区域和线性泛素四聚体发生紧密结合,其中线性泛素二聚体与变构位点的结合会引起RING1区域的构象变化,进而促进HOIL-1L与E2~Ub的结合;同时,IBR-RING2区域接近E2~Ub中间体,完成Ub在E2和HOIL-1L之间的传递;最后,HOIL-1L~Ub中间体与底物相互作用进而完成底物的单泛素化修饰。总之,该研究工作从结构角度对HOIL-1L的催化机制及其受线性泛素链结合调控的分子机理提供了新见解,扩展了领域内对RBR类型E3泛素连接酶的催化机制的认识。
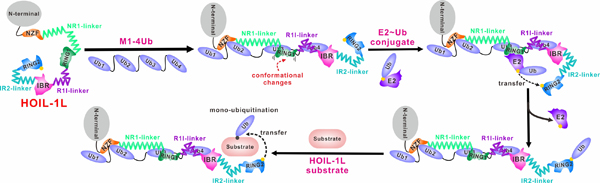
图2. 线性泛素链结合促进HOIL-1L的E3酶活性的作用模型图
潘李锋课题组已毕业的博士生许晓龙和博士后王亚茹为本文的共同第一作者。上述研究工作得到上海蛋白质中心的彭超博士团队在质谱分析方面的大力支持,同时获得了国家自然科学基金委、科技部国家重点研发专项项目、上海市科委、中国科学院和生命有机化学国家重点实验室的资助。
附件下载: