

核糖体肽是一类通过翻译后修饰化学创造的肽类天然产物,很多成员具有良好的生物活性。尽管来源于20种天然氨基酸,但经过各种后修饰酶的转化修饰,核糖体肽的结构复杂性和多样性往往超出我们的想象。上海有机所刘文课题组长期从事核糖体肽的翻译后修饰化学研究,近年来在烯基硫醚环肽的形成机制方面取得了一些进展(Cell Chem. Biol. 2021, 28, 675-685; J. Am. Chem. Soc. 2022, 144, 4431-4438; J. Am. Chem. Soc. 2023, 145, 7040-7047)。
烯基硫醚环肽是一类包含不饱和硫醚键特征结构的核糖体环肽。在所有已阐明的生物合成途径中,该结构片段都来源于前体肽中羧基端的烯基硫醇与上游脱氢氨基酸之间的反应,二者通过迈克尔加成形成一个被称作2-氨基乙烯基(甲基)半胱氨酸的非天然氨基酸(Avi(Me)Cys)。脱氢氨基酸可由丝氨酸、苏氨酸脱水或半胱氨酸脱硫形成,产生方式相对可变;而烯基硫醇的形成过程则非常保守,均由LanD黄素蛋白催化前体肽末端半胱氨酸氧化脱羧形成。前期的研究表明,产生的烯基硫醇物种反应性很强,如果没有上游的脱氢氨基酸作为亲核加成的对象,很容易在水相环境中转化降解。除了迈克尔加成反应以外,自然是否存在其它翻译后修饰化学,能够利用活泼的烯基硫醇物种产生不同于Avi(Me)Cys的不饱和硫醚环结构呢?
为了拓展烯基硫醇参与的后修饰反应类型,探索新颖的不饱和硫醚环构筑机制,刘文课题组从已知的LanD黄素蛋白出发,利用基因组挖掘策略,在InterPro数据库中筛选出373条潜在参与核糖体肽修饰的黄素蛋白序列。通过基因簇注释和分类,发现部分基因簇内不编码已知的脱水酶或脱硫酶,而编码保守的自由基酶。
进一步研究证实,黄素蛋白催化前体肽羧基端半胱氨酸氧化脱羧,形成烯基硫醇;而自由基酶则催化烯基硫醇与上游天冬酰胺Cβ的C-S键偶联,构筑不饱和硫醚环。在该过程中,自由基酶自身结合的[4Fe-4S]2+簇接受一个外源电子,并将该电子传递给结合的S-腺苷甲硫氨酸(SAM)辅因子,生成5’-脱氢腺苷自由基(5’-dA自由基);该自由基进而拔取前体肽天冬酰胺Cβ位的氢原子,形成碳自由基。接下来,碳自由基可能与被辅助[4Fe-4S]2+簇激活的烯基硫醇发生自由基偶联,形成C-S键;也可能先发生去质子化自由基淬灭,形成Ca-Cb双键,再接受烯基硫醇亲核进攻,形成C-S键。利用自由基化学构筑不饱和硫醚键的方式是前所未知的,通过基因组挖掘,作者进一步发现同时编码自由基酶和黄素蛋白的基因簇主要分布于放线菌门和厚壁菌门,基因簇的基因组成表现出多样性。该研究为探索核糖体肽中不饱和硫醚环构筑方式的多样性提供了借鉴。
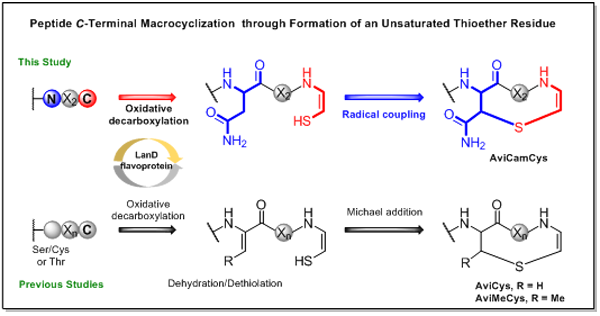
图1 区别于迈克尔加成方式的通过自由基酶构建烯基硫醚环的新机制
该研究成果近期在Angew. Chem. Int. Ed.上发表(DOI:10.1002/anie.202308733)。有机所博士后程伯涛和黄积武为共同第一作者,刘文研究员为通讯作者。该工作得到了国家自然科学基金委、科技部相关基金和上海市超级博士后项目的大力资助。
附件下载: