

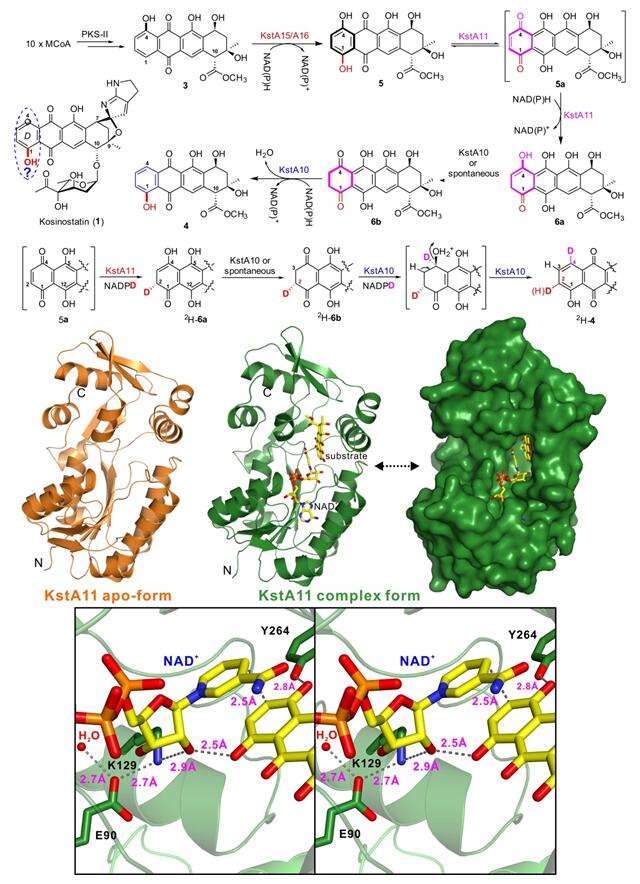
芳香聚酮类化合物是自然界广泛存在的天然产物,其中蒽环类化合物作为广泛应用的抗癌药物之一,得到基础研究和临床研究的广泛关注。但该类化合物一直存在心脏毒性等副作用,因此迫切需要开发新的蒽环类药物来满足临床需求。唐功利研究员课题组长期以来致力于微生物来源、结构复杂的抗肿瘤天然产物的生物合成及组合生物合成研究。越野他汀(Kosinostatin,KST,1)是由海洋小单孢菌产生的、具有独特螺环结构的蒽环天然产物,具有显著的抗肿瘤活性。在前期的工作中,他们克隆了KST完整的生物合成基因簇,并通过体外生化实验证实了独立的NRPS的腺苷化蛋白A能识别、活化烟酸,并上载到酰基载体蛋白PCP上,再经过类似色氨酸生物合成途径合成氮杂双环。基于鉴定的不含氮杂双环的1-OH蒽环中间体,揭示了由NRPS和系列后修饰合成氮杂双环模块的新途径;同时提出了该模块与II型PKS及后修饰合成的1-OH蒽环中间体经螺环偶联、再经过糖基化生成KST的汇聚式生物合成模式(Chem. Biol. 2013, 20, 796-805)。之后的研究表明该PKS-II催化合成的是典型的4-OH蒽环中间体,而和氮杂双环偶联的必须是1-OH蒽环中间体,由此推测KST的生物合成途径中包含了一个蒽环上C-4到C-1的羟基位置异构反应。
在本研究中,唐功利课题组经过多年的努力,通过体内遗传结合体外生化研究,并与潘李锋研究员课题组合作,通过关键去芳香化酶KstA11与底物和辅因子复合物的结构解析成功揭示了自然界如何实现蒽环上芳环的羟基区域异构化问题。首先双酶体系KstA15/A16催化化合物3的对位羟化产生1,4-双羟基化合物5;在KstA11作用下5异构化为5a,随后发生H-的1,4加成产生6a;6a在反应体系中自发/或者在KstA10诱导下异构化为较稳定的6b,KstA10催化6b的4位C=O还原及脱水重新芳构化得到化合物4。该四酶协同体系依次催化蒽环区域选择性羟化-不对称还原去芳香化-区域选择性还原脱水重新芳构化,相关酶催化反应的发现及酶学机制的阐明为进一步蒽环抗生素的代谢工程改造及生物催化体系的拓展奠定了基础。近日论文发表于PNAS(Proc. Natl. Acad. Sci. USA 2017, 114, 1554-1559),唐功利研究员课题组的张转博士与潘李锋研究员课题组的龚余康为共同第一作者。相关工作得到基金委、科技部、科学院、有机所及上海市科委的大力支持。
附件下载: