

细胞自噬是真核细胞内的一种高度保守并且受到严格调控的细胞分解代谢的过程。在这个过程中,细胞内待降解的物质,如,蛋白的聚集体,丧失功能的细胞器和入侵的病原菌等将被转运到溶酶体进行降解。由于细胞自噬在维持细胞的稳态和帮助细胞应激多种压力等方面发挥着非常关键的作用,其与众多的生理过程相关,如,胚胎再生,衰老和免疫应答。因此,细胞自噬功能的障碍与很多人类重大疾病(如,癌症和神经退行性疾病)相关。自噬体的成熟依赖于自噬囊泡的转运,目前为止,只有非常少数的参与自噬囊泡在细胞内转运的相关蛋白被确认,而关于这些蛋白的作用机制尚不清楚。
微管相关蛋白1轻链3A(MAP1LC3A/LC3A)隶属于ATG8家族,这些蛋白通过与磷脂酰乙醇胺(PE)相连而分布于初期的前自噬体膜上。与PE连接的ATG8家族蛋白分布于前自噬体的内膜和外膜上,并在选择性自噬中自噬体的再生及招募待降解物质的过程中发挥着关键作用。另外,ATG8家族蛋白还能够与自噬囊泡转运相关蛋白(如,FYCO1)相互作用,从而行使囊泡转运的功能。之前的研究表明,ATG8结合蛋白与ATG8家族蛋白之间特异的相互作用是由一个LC3相互作用区域(LIR)模序所介导的。经典的LIR模序含有一个保守的核心序列ΘxxΓ,其中Θ代表芳香族氨基酸残基(W/F/Y),Γ代表疏水性氨基酸残基。之前的研究表明,由LIR介导的ATG8家族蛋白与含有LIR模序的蛋白间的相互作用参与到自噬体的生物合成及待降解物质的招募过程,但是这种特异的相互作用是否参与到自噬囊泡的转运过程则鲜有研究。
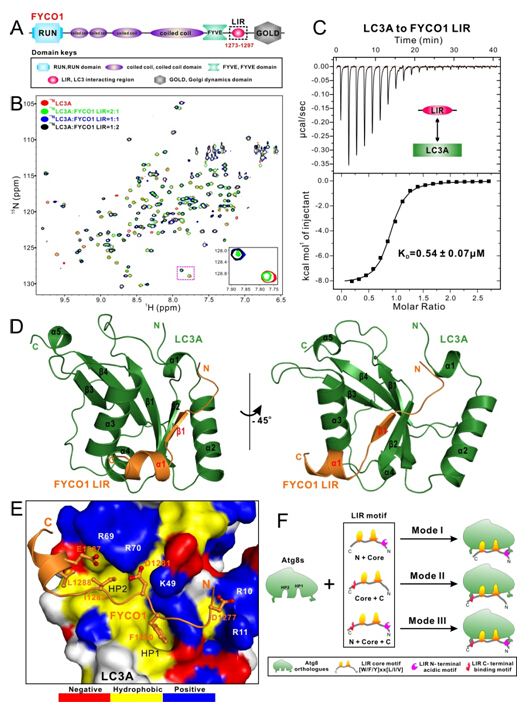
FYCO1蛋白是一种自噬受体,用于介导自噬体沿微管的正向运输。FYCO1的C-端含有一个LIR模序。FYCO1蛋白与ATG8家族蛋白间的相互作用与之前已报道的其他自噬受体(如SQSTM1/P62, NBR1, OPTINEURIN和CALCOCO2/NDP52)与ATG8家族蛋白间的相互作用方式不同,后者选择性地与分布于自噬体内膜上的ATG8结合,而前者则选择性地与分布于自噬体外膜上的ATG8结合。目前为止,FYCO1蛋白与自噬体外膜上的ATG8结合的机制尚不清楚,并且FYCO1蛋白与ATG8家族蛋白间具体的作用机制也有待研究。近期,中科院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究组在国际期刊《Autophagy》在线发表了题为“Structural Basis of FYCO1 and MAP1LC3A Interaction Reveals a Novel Binding Mode for ATG8 Family Proteins”的研究论文(Autophagy, 2016,DOI:http://www.tandfonline.com/eprint/fxKmJ6NpAKIvhs2kS3kk/full)。
该研究首次系统地阐述了FYCO1 LIR与ATG8家族蛋白之间的相互作用,发现FYCO1与LC3A和LC3B的相互作用最强。并通过解析LIR与LC3A的复合物结构,不仅首次揭示了FYCO1结合不同ATG8家族蛋白的选择性机制,而且阐明了一种新颖且普遍的LIR基序结合ATG8家族蛋白的作用模式,即LIR核心模序的C-端的几个氨基酸位点对于含有LIR模序的蛋白与ATG8家族蛋白互作的选择性是非常重要的。此项研究拓展了领域内对于由LIR模序介导的蛋白相互作用机制的认识,并且为进一步研究和阐明FYCO1参与自噬体运输过程的功能机制提供了重要的结构基础。
潘李锋课题组的博士生程小芳为本文的第一作者。上述研究工作得到国家青年千人计划项目、科技部973计划青年专题项目、国家自然科学基金委面上项目、上海市启明星项目、生命有机化学国家重点实验室及中国科学院的资助。
附件下载: