

细胞自噬是一种在真核细胞中高度受调控的、溶酶体依赖性的重要细胞代谢过程,主要参与降解细胞内的蛋白聚集体、衰老损伤的细胞器以及侵入细胞的病原体等过程。通过细胞自噬不仅可以为细胞提供养分来应对饥饿等压力,而且也可以通过降解体内受损的细胞器和毒性的生物大分子等来保护细胞免受损伤。因此细胞自噬在维持生物体的细胞动态平衡、发育、衰老、退化及免疫防御等方面都扮演着重要的角色,它的功能异常会引起大量的人类疾病,如癌症、神经退行性疾病以及病原体感染引发的炎症等。近年来,越来越多的研究表明在细胞自噬目标底物的识别环节,有一类自噬受体家族蛋白发挥着举足轻重的作用,它们可以特异性地识别相关底物并包裹到自噬体中,从而介导其选择性的降解清除。
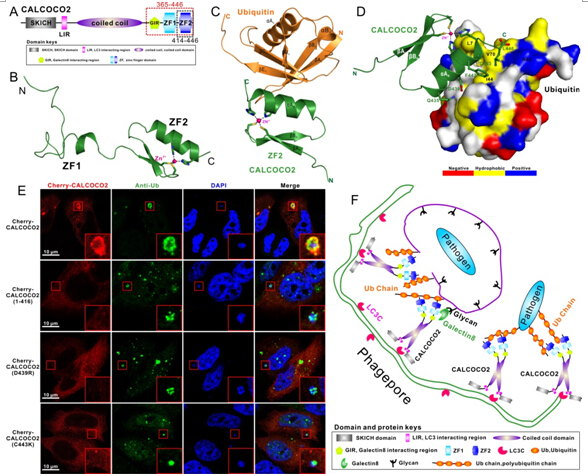
CALCOCO2/NDP52是一个典型的自噬受体蛋白,被报道参与选择性自噬降解入侵细胞的病原体(xenophagy)。它的C末端含有一个能结合泛素蛋白的UBZ结构域,能特异性的识别被泛素修饰的入侵病原体,从而介导其选择性的自噬降解清除(Nature Immunology, 2009, 10, 1215-1221)。但是,迄今为止,关于CALCOCO2蛋白UBZ区域的结构以及其特异性识别泛素化底物的分子机制未知。近期,中科院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究组在国际知名期刊《Autophagy》在线发表了题为“Molecular basis of ubiquitin recognitionby the autophagy receptor CALCOCO2”(自噬受体蛋白CALCOCO2识别泛素蛋白的分子机制)的研究论文(Autophagy, 2015, DOI:http://www.tandfonline.com/doi/full/10.1080/15548627.2015.1082025#abstract)。
该团队运用液态核磁共振技术成功地解析了CALCOCO2 UBZ的三维结构,发现该UBZ结构域由一个非常动态的、非典型的锌指结构域(ZF1)和一个典型的C2H2型的锌指结构域(ZF2)组成。并通过一系列的核磁共振和生化实验表明:CALCOCO2仅通过第二个C2H2型的锌指结构域来结合泛素蛋白,并且对于识别泛素单体和参与xenophagy的M1,K63,K48 连接的不同泛素链没有明显的选择性;然而,这两个锌指结构域对于CALCOCO2结合非典型的肌球蛋白Myosin6则是必须的。进一步通过X射线晶体衍射分析技术,他们解析了高分辨率的CALCOCO2 ZF2结合泛素单体的复合物三维晶体结构,从而详细揭示了CALCOCO2 ZF2结合泛素单体的分子机制。最后,运用细胞免疫荧光结合沙门氏菌侵染实验进一步从细胞功能角度证实,CALCOCO2 选择性识别被泛素化修饰的入侵病原体依赖于其ZF2结构域对于泛素蛋白的特异性识别。此项研究综合性地运用液态核磁共振波谱学、X射线晶体衍射等结构生物学手段结合系统的生物化学与细胞生物学实验技术,首次从结构角度揭示了CALCOCO2识别泛素的分子机制,并且系统性地研究了CALCOCO2识别不同泛素链的选择性机制,为进一步研究和阐明自噬受体家族蛋白选择性识别泛素化底物和参与选择性自噬降解入侵病原体的作用机制提供了重要的研究基础。
潘李锋课题组的博士后谢兴巧和博士生李发祥为本文的共同第一作者,另外,中科院上海生命科学研究院上海巴斯德研究所的陈昌斌课题组协助完成了沙门氏菌的侵染实验。上述研究工作得到国家青年千人计划项目、科技部973计划青年专题项目、国家自然科学基金委面上项目、上海市启明星项目、生命有机化学国家重点实验室及中国科学院的资助。
附件下载: