

蛋白质的泛素化修饰是一类具有多种效应的蛋白质翻译后修饰,与众多的生理过程和疾病密切相关。线性泛素化是一类新型的泛素化修饰,广泛参与炎症、抗入侵病原体的选择性自噬以及先天免疫相关的信号通路。线性泛素链组装复合物(linear ubiquitin chain assembly complex, LUBAC)是目前发现的唯一一个介导线性泛素链合成的E3泛素连接酶,由催化亚基HOIP和两个调节亚基SHARPIN、HOIL-1L所组成。尤其重要的是,LUBAC中任何一个亚基的功能缺失会在小鼠模型或人类身上引起炎症、免疫缺陷甚至胚胎死亡。已有的研究表明单独的HOIP处于低活性状态,自身的UBA结构域与催化核心区域之间存在自抑制。HOIL-1L或SHARPIN的结合可以激活HOIP,从而有效地催化线性泛素链的合成,但是目前HOIP自抑制的结构基础,以及SHARPIN和HOIL-1L激活HOIP的分子机理依然未知。
近期,中科院上海有机化学研究所生命有机化学国家重点实验室的潘李锋课题组成功解析了HOIP UBA结构域结合SHARPIN UBL结构域的复合物的晶体结构,发现SHARPIN与HOIL-1L可以同时结合在HOIP的UBA结构域上的两个截然不同的位点,既可以单独,也能协同激活HOIP的酶活性。系统的生物化学和酶学实验研究详细地揭示了HOIP的激活机制:SHARPIN或HOIL-1L的结合,改变了UBA结构域和催化核心区的相对取向,从而解除自抑制,并促进底物进入催化核心,加速线性泛素链合成。
该工作还清晰地解决了一个在以往研究中存在激烈争议的基本问题:HOIP的哪一个结构域直接结合了SHARPIN?该团队利用蛋白质复合物结构和生物化学实验证实了是HOIP的UBA结构域,而非NZF2结构域与SHARPIN结合。SHARPIN与HOIL-1L协同结合HOIP还很好地解释了LUBAC复合物在细胞内存在的三种不同组合,以及对应的不同酶活性。该项研究工作以标题“Structural Insights into SHARPIN-Mediated Activation of HOIP for the Linear Ubiquitin Chain Assembly ”在线发表于Cell子刊Cell Reports杂志(Cell Reports, October 3, 2017, DOI: http://www.cell.com/cell-reports/fulltext/S2211-1247(17)31306-2)。
潘李锋课题组的副研刘建平博士为本文的第一作者,上述研究工作得到国家青年千人计划项目、科技部国家重点研发专项项目、科技部973计划青年专题项目、国家自然科学基金委面上项目、上海市科委、生命有机化学国家重点实验室及中国科学院的资助。
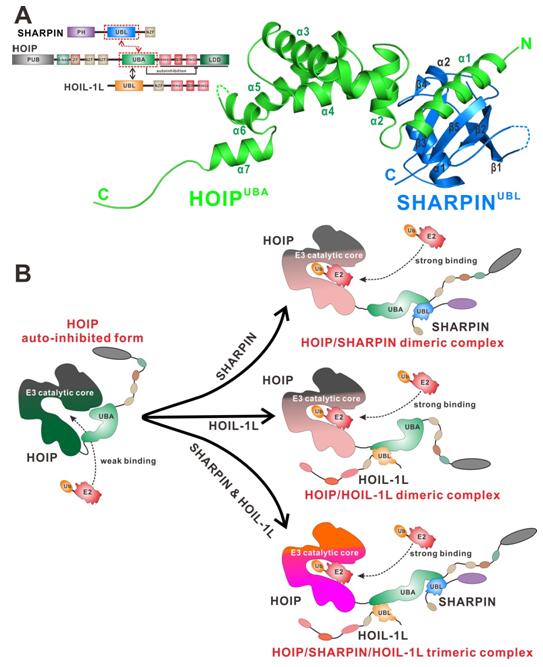
图1.(A)SHARPIN,HOIP,HOIL-1L蛋白的结构域组成以及HOIP的UBA结构域结合SHARPIN的UBL结构域的复合物晶体结构;(B)在LUBAC复合物的三种组合方式中,SHARPIN和HOIL-1L可以单独或协同结合HOIP,促进底物(E2)的结合,激活HOIP的酶活性。
附件下载: