

手性α-芳基羰基片段广泛存在于天然产物及药物分子结构中。高效合成手性α-芳基羰基片段一直是有机化学领域中的热点问题。近年来,廉价易得的α-卤代羰基化合物与芳基金属试剂间的不对称偶联反应成为了合成手性α-芳基羰基化合物的有效手段,但该方法仍然存在如下局限:1)现有的手性镍、钴、铁催化体系效率仍然偏低,催化剂用量一般大于5 mol %;2)需要使用活泼敏感的芳基格氏试剂或锌试剂等作为原料。相对而言,钯催化剂尽管价格较高,但催化剂用量可以大幅度降低;钯催化反应可以利用稳定易得的芳基硼酸作为原料,在官能团容忍性和底物普适性方面更具有优势。因此发展钯催化α-卤代羰基化合物与芳基硼酸的不对称交叉偶联反应仍然具有重要的研究价值。
事实上,钯催化α-卤代羰基化合物与芳基硼酸的偶联反应至今未能有效实现,主要问题是α-卤代羰基化合物在钯催化剂存在下极易发生二次转金属导致脱卤和硼酸自身偶联产物。因此如何有效抑制二次转金属成为实现钯催化α-卤代羰基化合物与芳基硼酸间高效偶联的关键。需要指出的是,抑制二次转金属是当今金属有机化学领域中仍然悬未解决的科学问题。
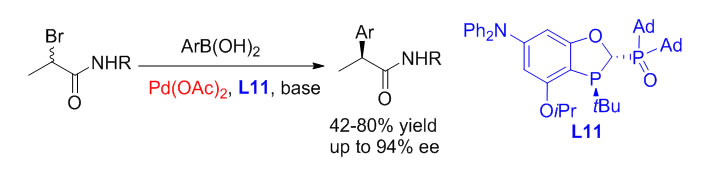
近日,中国科学院上海有机化学研究所生命有机国家重点实验室汤文军课题组提出大位阻P,P=O配体能有效抑制二次转金属。李博文等同学设计和发展了手性大位阻P,P=O配体L11并首次实现了钯催化α-溴代酰胺与芳基硼酸的不对称交叉偶联反应。利用Pd/L11为催化剂,一系列手性的α-芳基酰胺类化合物均可以以良好的收率和优秀的对映选择性得到,钯催化剂当量可降至0.5 mol %。和已报道的镍、钴和铁催化研究工作相比,钯催化偶联对杂环底物的兼容性更具优势。系列非甾体类抗炎药物布洛芬、萘普生及氟比洛芬均能通过该不对称偶联反应高立体选择性地制备。相关工作发表在Angew. Chem. Int. Ed. DOI: 10.1002/anie.201905174上,第一作者是博士研究生李博文。
该研究工作得到国家自然科学基金委、中国科学院战略性先导科技专项(B类)、中国科学院和生命有机化学国家重点实验室的大力资助。
附件下载: