

2024年7月5日,中科中山药物创新研究院段佳课题组、李翼课题组联合中国科学院上海药物研究所徐华强课题组、杨德华课题组共同在Cell Research 上发表了题为“Bitter taste receptor TAS2R14 activation and G protein assembly by an intracellular agonist”的最新研究成果。该研究报道了非甾体抗炎药物氟芬那酸改造化合物Compound 28.1(Cpd 28.1)结合苦味受体TAS2R14分别偶联Ggust和Gi复合物结构,分辨率高达2.89埃和2.7埃,揭示了苦味受体独特的双口袋配体识别和G蛋白偶联机制。
味觉同视觉、触觉以及嗅觉等感知功能一样,对于人类的生活有着极其重要的作用。已有研究表明,人类主要有5种基本味觉,分别是酸、甜、苦、鲜和咸味,其中苦味、甜味和鲜味均由GPCR介导,酸味和咸味目前主要认为由离子通道介导1。研究表明,人体中苦味受体总共有25个成员2,主要在味蕾中的味觉受体细胞中表达,用于感知口腔食物中的苦味物质和有毒物质,帮助人类识别食物的味道同时避免有毒物质的摄入1,3。然而,近年来有研究指出苦味受体不仅在口腔组织中表达,在脑、肠道、生殖系统、胰腺等口腔外周组织中同样具有非常高的表达丰度4。大量研究结果显示,苦味受体与上呼吸道感染引起的适应性免疫、牙周炎、支气管收缩、肥胖、肿瘤以及人体与微生物互作等生理、病理过程密切相关,提示苦味受体是极其重要的潜在药物靶点5-10。因此,系统阐明苦味受体的配体识别、受体激活以及G蛋白偶联机制对于更好理解人体苦味感知以及基于苦味受体的理性药物设计具有重大意义。
本项研究指出,Cpd 28.1激活TAS2R14不仅能够招募味觉受体特异的G蛋白Ggust,而且还具有显著的Gi2招募活性(Fig. 1)。上述实验结果与文献报道相契合11,提示苦味受体TAS2R14可能在口腔外周组织通过偶联Gi发挥G蛋白信号依赖的生理功能。
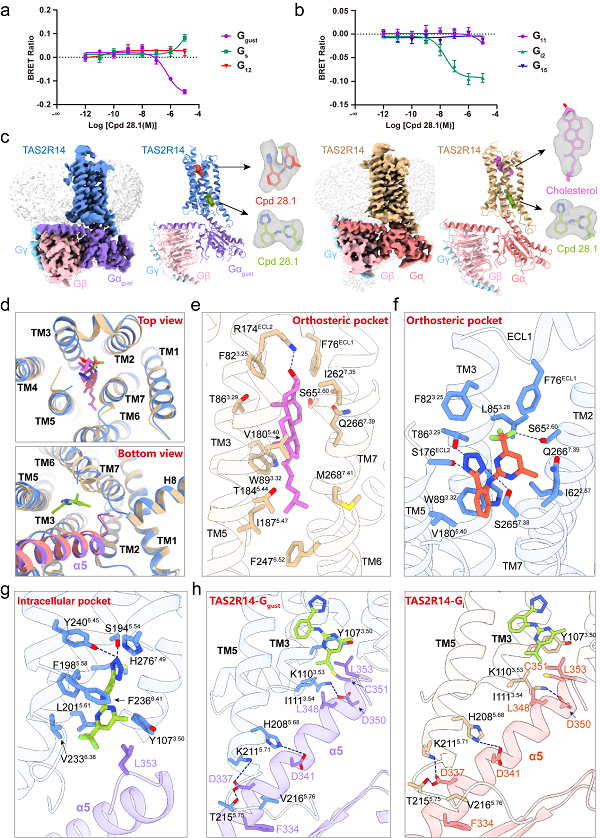
Fig. 1 G protein recruitment activity of TAS2R14
其次,该研究意外发现TAS2R14存在1个独特的胞内口袋容纳配体Cpd28.1,与最近报道的研究相近12-14,不同的是,本研究首次证实TAS2R14的正构口袋中存在的是胆固醇分子与Cpd 28.1的混合物(Fig. 2a)。基于正构口袋中的配体密度,研究人员认为在TAS2R14-Ggust复合物中,正构口袋更倾向结合配体Cpd 28.1,即胞内、胞外双口袋配体识别模式14,而在TAS2R14-Gi复合物中,正构口袋更倾向于结合胆固醇分子,这种独特的配体识别模式可能与其配体多样性有关,也可能由下游不同的G蛋白引起(Fig. 2b)。此外,该研究还强调了受体的正构口袋和胞内口袋之间的芳香氨基酸残基簇形成的疏水网络与受体激活密切相关;最后,该研究指出,Ggust和Gi与受体的偶联模式相似,均是通过α5插入受体TM5/6外移形成的疏水口袋并与TM3, TM5, TM6, ICL2, 和 ICL3形成疏水和极性相互作用稳定了受体-G蛋白复合物,这可能归结于Ggust和Gi的α5序列具有较高保守性。
综上所述,本研究较为系统地阐明了苦味受体TAS2R14的配体识别,受体激活以及G蛋白偶联机制。值得一提的是,本研究中的配体Cpd 28.1与此前报道的PCO371和SBI553有所不同。一方面,三者均能结合在胞内口袋,但Cpd28.1是一个完全激动剂,而PCO371和SBI553则分别是G蛋白偏向性激动剂和Arrestin偏向性激动剂15,16;另一方面,Cpd 28.1能同时结合在正构口袋和胞内口袋,是一种独特的胞内、胞外双口袋识别模式,为基于结构的偏向性药物和多口袋靶向药物设计提供了参考依据。
中科中山药物创新研究院科研助理陶乐乐、博士后王冬雪,上海市高峰电镜中心执行主任袁青宁,上海药物所副研究员赵丰辉为本论文的共同第一作者。段佳研究员、杨德华研究员、李翼研究员及徐华强研究员为共同通讯作者。上海市高峰电镜中心负责了该项研究冷冻电镜数据的收集,上海市高峰电镜中心吴凯、胡雯对样品制备和数据收集提供了大量帮助。该工作得到了国家自然科学基金、青年人才托举项目、上海扬帆计划等项目资助。
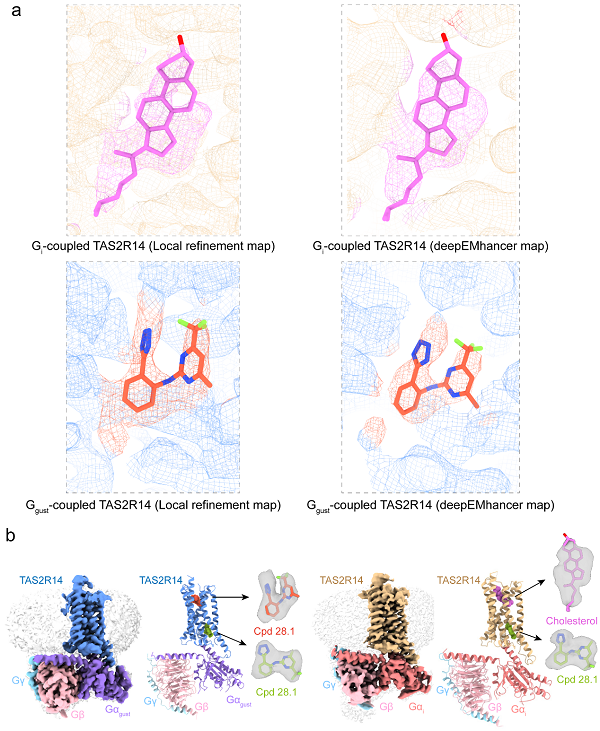
Fig. 2 Overall structures of the Ggust- and Gi-coupled TAS2R14
全文链接: https://www.nature.com/articles/s41422-024-00995-4
附件下载: