

2024年7月29日,中国科学院上海药物研究所生命过程小分子调控全国重点实验室陈浩课题组与刁星星课题组合作在Journal of Medicinal Chemistry发表了题为“Radioactive ADME Demonstrates ARV-110’s High Druggability Despite Low Oral Bioavailability”的研究论文,并获选封面文章。研究团队运用放射性标记技术,成功合成了[14C]ARV-110,作为PROTACs(蛋白水解靶向嵌合体)的代表性模型化合物。研究揭示,PROTACs即使在口服生物利用度较低的情况下,依然能够展现出良好的特异性和生物活性。该研究挑战了传统观念,不仅为PROTAC药物的未来发展提供了宝贵的放射性药物代谢和药代动力学数据,而且为药物设计和开发开辟了新的视野,表明了即使生物利用度不是最优,药物依然可以发挥出色的治疗效果。
PROTAC代表了一种创新的药物设计策略,它利用细胞内的泛素-蛋白酶体系统来特异性地降解目标蛋白质。尽管PROTAC技术在克服药物抗性、降解传统上难以成药的靶标等方面展现出巨大潜力,但其在实际应用中仍面临挑战,例如PROTAC分子的高分子量、低溶解性和低渗透性可能会影响其口服生物利用度,进而导致药代动力学特性的变异。
在本项研究中,研究团队对ARV-110这一PROTAC药物在大鼠体内的药代动力学进行了系统性研究及发现:
1、生物利用度研究:通过放射性药代动力学试验,发现ARV-110在禁食和不禁食的大鼠中的口服生物利用度分别为5.62%和20.97%。研究推测,高脂饮食可能通过刺激胰腺和胆汁的分泌,增加胆汁酸离子的表面活性作用,从而提高脂溶性药物的溶解度和吸收率。
2、疗效验证:在治疗实验中,发现即使是小剂量的ARV-110(0.5 mg/kg)也展现出了优于恩杂鲁胺(20 mg/kg)的治疗效果,证实了ARV-110的高特异性催化药效,并进一步验证了PROTAC药物的药效与其药代动力学特性不直接相关的独特机制。
3、组织靶向性分析:通过定量全身放射性自显影(QWBA)技术,证明了ARV-110在皮下前列腺肿瘤中的特异性分布,其在肿瘤与血浆中的药物暴露比高达3.99,远超过77.5%的组织。此外,药物在肿瘤中的清除速度慢于全身循环,表明延长药物暴露时间有利于持续抑制肿瘤生长。
4、代谢途径解析:放射性代谢物谱分析显示,ARV-110的主要代谢途径是酰胺水解,且此过程不需要代谢酶的催化。这一发现对于理解具有戊二酰亚胺官能团的药物,如沙利度胺及其衍生物ARV-110的稳定性和手性翻转能力,具有重要意义。
该研究揭示了PROTAC药物独特的事件驱动和催化作用模式,其结果为开发新型口服PROTAC药物、提高口服吸收率方面提供了宝贵见解;对于蛋白质合成周期较长的靶点,单次给药有望实现长期疗效,从而延长给药间隔。此项研究从放射性DMPK的角度为研发未来的PROTAC药物提供了科学依据。
上海药物所博士研究生何伊菲和郑元东副研究员为本论文的共同第一作者,陈浩研究员和刁星星研究员为共同通讯作者。该研究得到了国家重点研发计划、国家自然科学基金和广东省重点研发计划等项目的支持。
全文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c01104
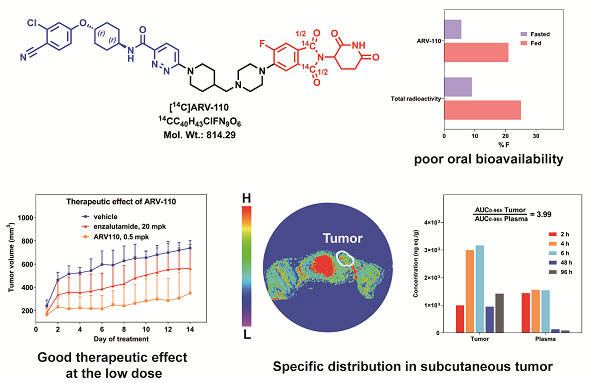
[14C]ARV-110的结构以及研究结果
附件下载: