

蛋白质通过自组装形成的病理性淀粉样纤维聚集体,是多种神经退行性疾病(如:阿尔兹海默病,帕金森病及渐冻人症等)的共同病理特征,并在相应疾病的发生发展过程中起到关键的病理作用。例如:作为帕金森病及多种突触核蛋白病的核心致病因子,α-突触核蛋白(α-syn)的纤维聚集可以通过与多种膜受体蛋白,内源代谢分子,及蛋白酶体等的互作来介导病理聚集的细胞间传播,并诱发炎症反应。病理聚集体中的柔性区在底物识别中起到至关重要的作用。然而,由于柔性区构象的高度动态性及纤维整体的固态性质,对其本身构象及与底物互作的结构基础与分子机制研究还非常匮乏,这极大地阻碍了我们对于病理纤维聚集体在不同神经退行性疾病中病理毒性机制的深入理解。
2023年2月16日,中科院上海有机化学研究所交叉中心的刘聪团队与中国科学技术大学生命科学学院项晟祺团队合作在Journal of the American Chemical Society杂志上发表了一篇题为 “Conformational Dynamics of an α-Synuclein Fibril upon Receptor Binding Revealed by Insensitive Nuclei Enhanced by Polarization Transfer-Based Solid-State Nuclear Magnetic Resonance and Cryo-Electron Microscopy”的研究论文。该工作通过利用以非灵敏核的极化转移增强为基础(INEPT-based)的固态核磁1H检测技术和冷冻电镜技术,首次在原子水平表征了帕金森病致病蛋白a-syn病理性纤维高度柔性的末端区域(terminal regions, TRs)的动态构象,并发现TRs在结合介导其细胞间病理传播的关键受体LAG3过程中,经历了显著的构象变化,并同时引起纤维核心区的构象重排(图1)。该工作展现了有机结合固态核磁共振技术与冷冻电镜技术对于探究病理蛋白自组装聚集过程中的构象变化及聚集体与底物互作研究中的重要意义;为系统研究病理蛋白聚集体的结构与毒性在方法学上提供了新的手段与策略。
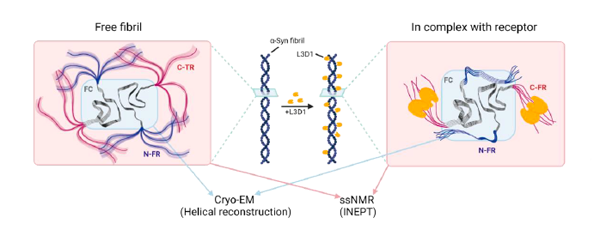
图1. 冷冻电镜技术与固态核磁技术联用表征病理蛋白淀粉样纤维组装聚集及与结合蛋白互作的分子机制
在本工作中,研究者首先利用冷冻电镜技术解析了a-syn纤维刚性纤维核心区(fibril core, FC)的原子结构,其由V37-Q99位氨基酸组成,而高度柔性的N-TR和C-TR在电镜结构中不可见。研究者们进一步利用固态核磁INEPT-based 1H检测技术对a-syn纤维柔性的TRs进行研究,发现a-syn的核心区域形成纤维后,其N-TR和C-TR松散的在a-syn纤维表面分布,并且它们所处的化学环境与其在a-syn单体中非常相似。进一步的核磁滴定实验表明,特异性识别a-syn纤维的膜表面受体LAG3 的D1结构域(L3D1)直接与a-syn纤维中柔性的C-TR结合的。有趣的是,L3D1与a-syn纤维中柔性的C-TR结合后,诱导了原本高度柔性的N-TR会被纤维核心招募而变得刚性,从而形成一个呈现显著纤维表面性质差异的新颖纤维核心构象(图2)。
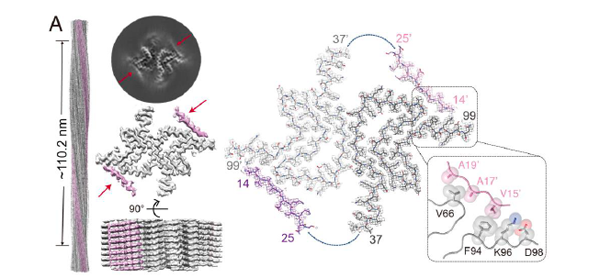
图2. α-Syn纤维与受体蛋白L3D1结合诱导的病理纤维核心结构重排
综上,该工作系统阐释了受体蛋白结合诱导的a-syn病理性纤维构象变化和结构重排现象,在原子水平上揭示了病理性a-syn纤维聚集体的关键受体蛋白LAG3,通过结合a-syn纤维柔性的末端结构域进而引起a-syn纤维核心发生构象变化的分子机制。该工作有助于深入理解a-syn病理纤维聚集的动态构象和其与病理毒性之间的关联。更为重要的是,本工作建立了一种新颖有力的冷冻电镜与固态核磁共振技术联用方法,以表征病理淀粉样纤维构象动态变化及其与底物识别互作过程。
上述工作由中科院上海有机所生物与化学交叉研究中心的张胜男副研究员,中国科学技术大学李娟和有机所交叉中心徐千蕙为共同第一作者,有机所交叉中心刘聪研究员和中国科学技术大学项晟祺教授为共同同通讯作者。经费支持主要来自于国家重点研发计划项目,国家自然科学基金委基础科学中心,科学院先导项目及上海市科委等项目及基金的资助。
附件下载: