Piezo家族离子通道感知机械力环境变化,将机械力信号转化为下游电化学信号,介导多种重要的生理活动,包括触觉、痛觉的感知,淋巴管发育,血压调节,神经轴突再生等。其功能的异常会导致触觉超敏痛、淋巴管发育不良、神经退行性疾病等。Piezo2作为触觉感受器的发现工作获得了2021年的诺贝尔生理学或医学奖,但是围绕Piezo家族蛋白功能机制的研究,目前仍存在诸多未解之谜。比如Piezo蛋白自身能够感知和传递机械力信号1-2,但是研究人员很早就已经发现,与异源表达的Piezo蛋白相比,在很多细胞系中内源表达的Piezo表现出慢失活的门控特性(slow inactivation)3-5。但研究人员对这种门控特性差异产生的原因和生理意义并不清楚,推测与蛋白的相互作用或膜局部的磷脂组成等有关。由于许多离子通道都存在与之相结合的附属亚基来调控其亚细胞定位和门控特性,长期以来研究人员也致力于寻找能够调控Piezo蛋白功能的附属亚基。附属亚基的定义通常为(1)自身并不参与离子孔道形成 (2)与孔道蛋白有直接和稳定的相互作用 (3)在异源表达系统中能够调控通道特性 (4)在内源细胞中能够调控通道门控特性6。尽管研究人员做出了巨大的努力,目前还没有发现能够满足以上四个标准的Piezo附属亚基,也阻碍了对Piezo蛋白不同门控特性分子机制的研究。
2023年8月18日,澳大利亚Victor Chang心脏研究所Charles Cox课题组与中国科学院上海有机化学研究所生物与化学交叉研究中心张一小课题组在Science上发表了题为MyoD-family inhibitor proteins act as auxiliary subunits of Piezo channels(MyoD家族抑制蛋白作为Piezo通道的辅助亚基)的合作文章。首次报道了MyoD家族抑制蛋白MDFIC和MDFI是Piezo1/2的结合蛋白,作者通过结构解析和功能研究,发现MDFIC通过C末端一段高度脂质化修饰的两亲性α螺旋从侧面插向Piezo的孔道模块,并证实该α螺旋能够引起外源和内源Piezo1/2的慢失活过程。该研究鉴定了首个Piezo蛋白附属亚基,解释了在许多细胞类型中观察到的内源 Piezo 通道截然不同的门控特性,为Piezo通道功能机制的研究提供了全新的方向。
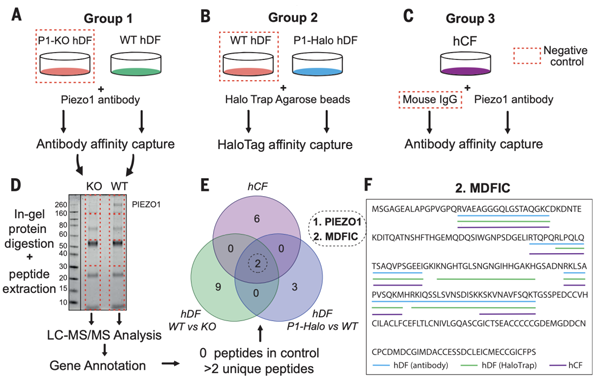
图1.亲和捕获质谱鉴定MDFIC是Piezo结合蛋白
在本文中,作者首先利用CRISPR/Cas9 编辑人真皮成纤维细胞 (hDF) 中的Piezo1 (在多种组织来源的成纤维细胞中Piezo1表现出较慢的失活特性), 通过三种不同的策略来鉴定Piezo1结合蛋白。通过严格的质谱数据分析,确定三组中都存在但在各自的阴性对照中不存在的Piezo1相互作用蛋白。最终仅鉴定出两种蛋白质,第一种是Piezo1,第二种是研究较少的转录调节因子MDFIC(图1)。作者通过免疫共沉淀在HEK293T细胞中验证了MDFIC与Piezo1/2之间的相互作用。
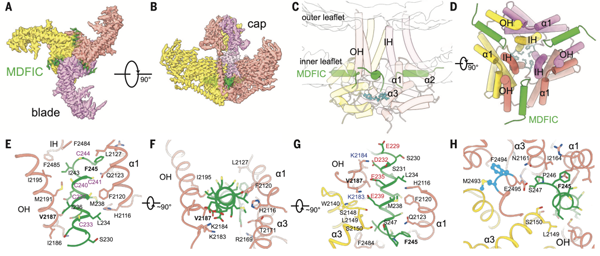
图2. Piezo1-MDFIC冷冻电镜三维结构
为进一步探究MDFIC与Piezo的相互作用模式,研究人员利用冷冻电镜单颗粒三维重构,解析了Piezo1-MDFIC 复合物的高分辨率三维结构,发现MDFIC通过C末端一段富含半胱氨酸的两亲性α螺旋从侧面插向Piezo的孔道模块。该α螺旋横躺于磷脂双分子层内侧,与Piezo蛋白的多个氨基酸存在相互作用。在Piezo与MDFIC上均有能够引起淋巴系统发育异常的突变位于该相互作用界面上,提示了Piezo-MDIFC复合物在功能上的重要性(图2)。
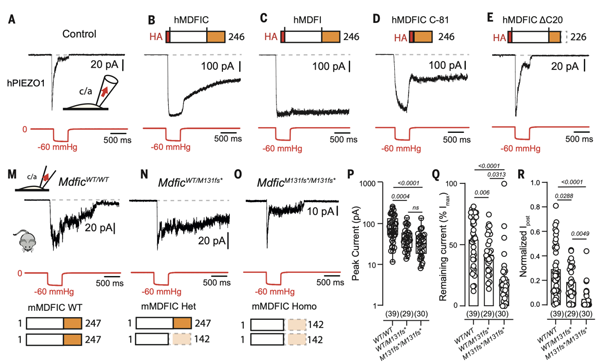
图3. MDFIC/MDFI调控Piezo蛋白的门控特性
由于MDFIC结合在Piezo的孔道模块,作者推测MDFIC可能会调控Piezo的门控特性。通过全细胞膜片钳,作者证实MDFIC和MDFI能够显著引起Piezo1/2通道的慢失活门控特性。有意思的是该门控特性是由与Piezo相互作用的最C末端的两亲性α螺旋所介导,缺失该α螺旋的MDFIC则不能引起Piezo的慢失活。同时作者验证了该α螺旋对于内源Piezo的慢失活同样重要(图3)。
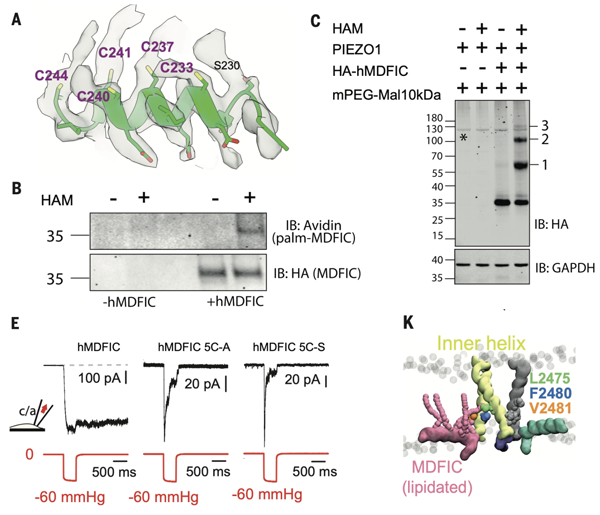
图4. MDFIC的脂质化修饰参与Piezo门控调节
接下来,作者初步探究了MDIFC引起Piezo慢失活的分子机制。由于在Piezo1-MDFIC复合物冷冻电镜密度中,位于细胞膜一侧的5个半胱氨酸上均具有多余的密度,作者推测其为脂质化修饰。通过酰基生物素交换实验作者证实MDFIC的C末端存在棕榈酰化修饰。接下来作者探究了MDFIC脂质化修饰对Piezo门控特性的影响。将5个Cys突变为5个Ala或者5个Ser之后,缺少脂质化修饰的MDFIC仍能够与Piezo相结合,但是无法引起Piezo的慢失活,提示MDFIC的脂质化修饰对于Piezo的门控特性有重要调节作用。通过分子动力学模拟,作者发现MDFIC上的脂质化修饰能够与在Piezo失活过程中起关键作用的L2475相互作用,可能介导了MDFIC对于Piezo蛋白的调控(图4)。
综上所述,本文鉴定了首个Piezo蛋白附属亚基MDFIC,通过结构解析和功能研究,揭示了MDFIC介导Piezo慢失活的分子机制。
澳大利亚Victor Chang心脏研究所博士后周子晶与中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生马晓诺为本文共同第一作者。Charles Cox教授与张一小研究员为本文共同通讯作者。澳大利亚国立大学的Ben Corry教授以及博士研究生Yie Chang Lin, 南方科技大学的姚明曦教授以及本文其他作者也做出了重要贡献。该工作得到了科技部科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金海外优青项目、中科院上海分院青年英才培育计划、上海脑中心求索杰出青年项目及上海市科委等项目的资助。
原文链接
参考文献
1. B. Coste et al., Nature 483, 176–181 (2012).
2. R. Syeda et al., Cell Rep. 17, 1739–1746 (2016).
3. B. Coste et al., Science 330, 55–60 (2010).
4. S. Wang et al., Nat. Commun. 11, 2303 (2020).
5. D. Jakob et al., J. Mol. Cell. Cardiol. 158, 49–62 (2021).
6. D. Yan, S. Tomita, J. Physiol. 590, 21–31 (2012).





