上海有机所在人源MON1A/CCZ1/C18orf8复合物识别和激活Rab7A的分子机制方面取得新进展
Rab7A是小G蛋白中Rab家族蛋白的一员,在哺乳动物细胞自噬和内体途径中发挥重要作用。与其他小G蛋白类似,Rab7A作为一种分子开关,可在结合GTP的激活状态与结合GDP的失活状态之间切换,这一过程由相应的鸟苷酸交换因子(GEF)和GTP酶活化蛋白(GAP)所介导。其中,MON1/CCZ1/C18orf8复合物作为Rab7A的GEF因子,可识别结合GDP、处于失活状态的Rab7A,并将其转变为结合GTP的激活状态。一旦被激活,Rab7A可介导相关下游效应蛋白的招募,在自噬体与溶酶体或晚期内体融合等过程中起着至关重要的作用。但是,目前哺乳动物MON1/CCZ1/C18orf8复合物的三维结构及其结合Rab7A发挥GEF功能的分子机制仍然未知。
近期,中国科学院上海有机化学研究所的潘李锋课题组与张一小课题组合作,在Protein & Cell杂志在线发表了题为 “Mechanistic insights into the GEF activity of the human MON1A/CCZ1/C18orf8 complex”的通讯论文(https://doi.org/10.1093/procel/pwaf018)。该团队首先利用凝胶共迁移、多角度静态光散射和细胞免疫共沉淀等实验方法,详细研究了人源MON1A/CCZ1/C18orf8复合物与Rab7A之间的相互作用,发现MON1A/CCZ1/C18orf8复合物只会结合锁定在GDP结合构象的Rab7A。随后,利用冷冻电镜技术,该团队首次解析了人源MON1A/CCZ1/C18orf8/Rab7A T22N四元复合物的三维结构。在该复合物结构中,MON1A和CCZ1各自包含三个LD结构域(LD1-LD3),C18orf8包含一个α-螺线管结构域和一个WD40结构域,而Rab7A则采取经典的Rab家族蛋白折叠模式,并结合在MON1A和CCZ1的两个LD1结构域组成的界面。有趣的是,在解析的复合物结构中,Rab7A处于一个特殊的中间态构型, 并未结合GDP分子和Mg2+离子。进一步的结构分析发现,Rab7A开关一区(Switch I)的构象变化是MON1A/CCZ1/C18orf8复合物识别并催化Rab7A核苷酸转变的关键。其中,结合GDP的Rab7A因其开关一区的Y37等残基不参与GDP的结合,因此可被MON1A/CCZ1/C18orf8复合物特异性地识别。当结合GDP的Rab7A被MON1A/CCZ1/C18orf8复合物识别后,Rab7A开关一区的F33、Y37等关键残基与MON1A/CCZ1/C18orf8复合物发生相互作用,使开关一区整体下翻并远离Rab7A的核苷酸结合口袋,进而削弱Rab7A对GDP的结合。同时,开关一区上带正电荷的K38残基插入到核苷酸结合口袋中,占据Mg2+的位置,进一步减弱Rab7A对GDP的结合,并最终使GDP解离。随后,细胞质中高浓度的GTP会补充结合进来,并诱导开关一区的Y37与其γ位的磷酸基团发生氢键相互作用,进而使开关一区整体上翻并参与结合GTP分子,最终使结合GTP的Rab7A从MON1A/CCZ1/C18orf8复合物上解离,完成整个催化过程。综上所述,该研究工作首次解析了人源MON1A/CCZ1/C18orf8复合物结合Rab7A的复合物结构,并对MON1A/CCZ1/C18orf8复合物催化Rab7A核苷酸转变的分子机制提供了新见解,扩展了领域内对于小G蛋白Rab7A活性调控的分子机制的认识。
潘李锋课题组的唐宇斌博士和张一小课题组的韩瑶瑶同学为本论文的共同第一作者,潘李锋研究员和张一小研究员为该论文的共同通讯作者。上述研究工作得到了国家自然科学基金委、科技部国家重点研发专项项目、中国科学院青年交叉团队项目和生命过程小分子调控全国重点实验室的资助。
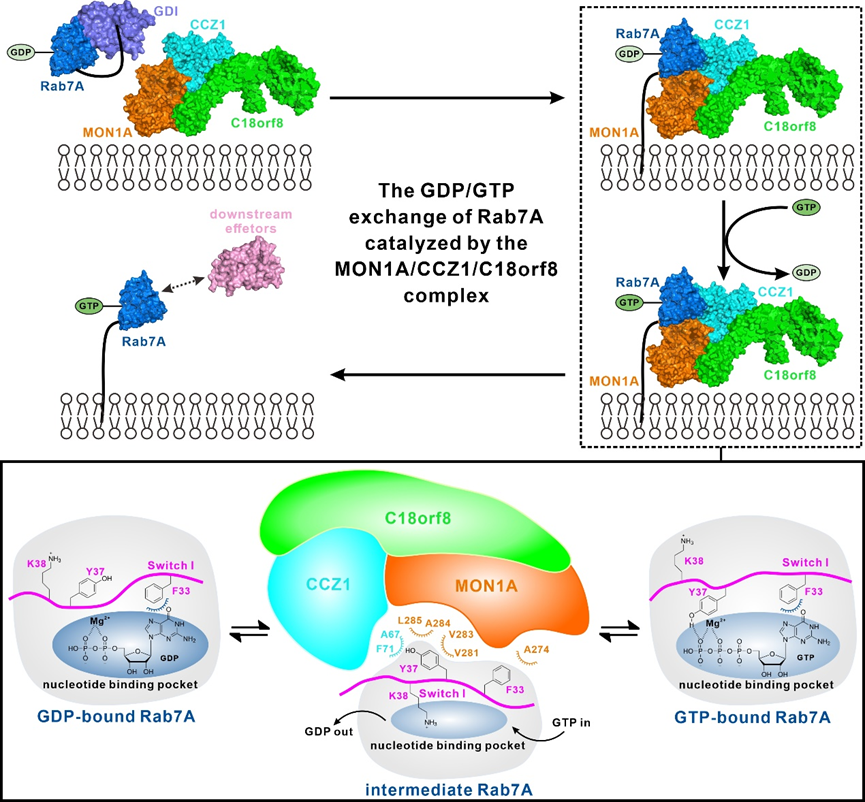
图1. MON1A/CCZ1/C18orf8复合物催化Rab7A核苷酸转变的工作模式图