上海有机所合作在吲哚萜模拟物作用机制研究中取得进展
吲哚萜是一大类具有吲哚和萜类杂合结构的天然产物。该类化合物具有多样的生物学功能,近年来其抗肿瘤活性引起较多关注。上海有机所生命过程小分子调控国重室李昂课题组前期系统发展了Prins环化策略,实现了indotertine A、hapalindole Q、sespenine、epoxyeujindole A、14-hydroxyaflavinine等多类吲哚萜的化学合成。在此基础上,该课题组与华东理工大学何薇薇课题组、海军军医大学张卫东课题组合作,运用分子间共轭加成方法构建了吲哚萜模拟物库,并从中发现化合物JP18具有诱导细胞周期阻滞的作用 (Chem. Asian J. 2016, 11, 2715)。最近,李昂课题组与何薇薇课题组、张卫东课题组以及上海药物所罗成课题组深入合作,发现JP18的卤代类似物 (+)-6-Br-JP18和 (+)-6-Cl-JP18具有更强的细胞周期阻滞活性,并确定了这两个化合物都作用于β-微管蛋白 (β-tubulin) 的秋水仙碱结合位点 (colchicine-binding site),阐释了它们导致人类细胞的中心粒蛋白A (CENP-A) 过度累积的机制 (Target identification and mechanistic characterization of indole terpenoid mimics: proper spindle microtubule assembly is essential for Cdh1-mediated proteolysis of CENP-A.Adv. Sci.2024, 2305593)。
CENP-A是中心粒特有的一种组蛋白H3变体,在着丝点定位和染色体分离过程中发挥关键作用。然而,该蛋白在人类细胞中的调控机制尚不完全清楚。合作团队通过对JP18的构效关系研究发现,吲哚6位卤代类似物 (+)-6-Br-JP18和 (+)-6-Cl-JP18 具有更强的M期阻滞活性。由于难以获得合适的衍生化探针分子以进行基于亲和力层析的靶点识别,合作团队运用了加州大学洛杉矶分校黄菁等发展的基于药物亲和力响应靶点稳定性 (DARTS) 的无标签靶点识别方法,鉴定tubulin为 (+)-6-Br-JP18的潜在作用靶点。X射线晶体学分析表明两个卤代类似物均作用于colchicine-binding site,与吲哚氮相连的氢原子和6位的卤原子分别通过氢键和卤键与β-tubulin Asp251和Asn350残基作用。合作团队发现包括 (+)-6-Br-JP18和 (+)-6-Cl-JP18在内的微管抑制剂使人类细胞中APC/C E3泛素连接酶共激活剂Cdh1水平下调及CENP-A水平上调。通过进一步机制研究,揭示了APC/CCdh1在人类细胞中介导CENP-A的泛素化−蛋白酶体降解,证实了微管正常组装对于CENP-A降解的必要性。总之,合作团队充分利用小分子工具的独特优势,建立了微管组装/解组装与CENP-A过度累积之间的联系,阐释了Cdh1在CENP-A调控中的关键作用 (图1)。鉴于CENP-A异常上调与染色体不稳定性 (CIN) 之间的密切关系以及CIN与微管抑制剂耐药性之间的潜在关系,此项研究有助于理解微管抑制剂诱导耐药性出现的机制细节,并提示了Cdh1在防止癌症治疗中此种耐药性出现方面的潜在作用。从更广阔的角度,此项研究展示了天然产物及其模拟物/类似物作为切入工具在理解生物学机制方面的独特优势。
华东理工大学研究生彭琰和张雨萌、华东理工大学−上海有机所联合培养研究生方阮、上海药物所研究生蒋昊为相关论文的共同第一作者。此项研究受到了国家自然科学基金委、中国科学院、上海市科委等机构资助。李昂研究员获得了新基石科学基金会的科学探索奖支持。
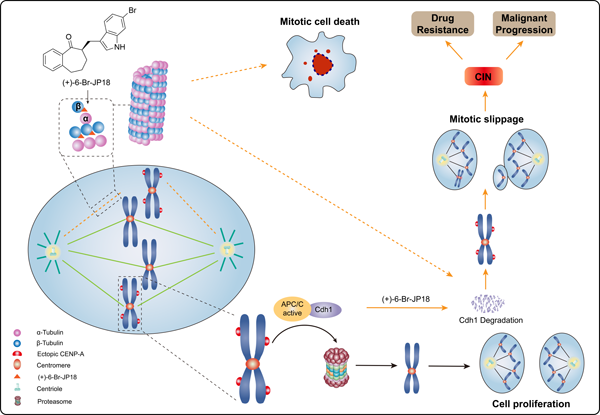
图1. (+)-6-Br-JP18破坏纺锤体微管组装和影响Cdh1介导的CENP-A溶酶体降解的作用机制示意图。该化合物通过靶向β-tubulin的秋水仙碱结合位点破坏微管组装,从而导致APC/C E3泛素连接酶共激活剂Cdh1的下调以及APC/C底物CENP-A的过度累积。这种累积会影响有丝分裂过程中染色体的精确分离,并可能引起染色体不稳定性的出现。